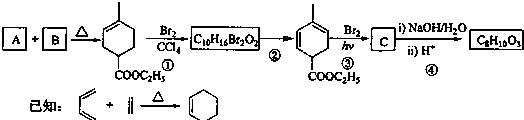
题目内容
下面是几种实验中常用的仪器: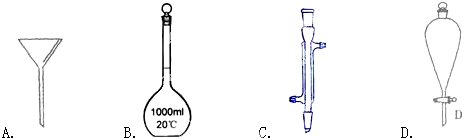
(1)写出下列仪器的名称:C ;D
(2)仪器中,使用前必须检查是否漏水的有 (填序号),分离四氯化碳与水的混合物除图中给出仪器及铁架台(带铁圈)外还需要的仪器有: ,四氯化碳在 (填“上层”或“下层”).
(3)实验室需要240mL物质的量浓度为0.46mol.L-1的硫酸,现用密度为1.84g?cm-3,溶质的质量分数为98%的浓硫酸配制.
①完成该实验需要的仪器有 .
②选用量筒规格为 (填序号),需量取 mL的浓硫酸.
A.10mL B.20mL C.50mL
③下列实验步骤中,正确的操作顺序应该是: .
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌.
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸,冷却后沿玻璃棒注入容量瓶中;
D.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
E.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
F.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
④下列操作使所配溶液的物质的量浓度偏高的是
A.洗净容量瓶未干燥即用来配制溶液
B.用量筒量取浓硫酸时仰视观察凹液面.
C.未冷却到室温就将溶液转移到容量瓶并定容
D.往容量瓶中转移溶液时,有少量液体溅出.

(1)写出下列仪器的名称:C
(2)仪器中,使用前必须检查是否漏水的有
(3)实验室需要240mL物质的量浓度为0.46mol.L-1的硫酸,现用密度为1.84g?cm-3,溶质的质量分数为98%的浓硫酸配制.
①完成该实验需要的仪器有
②选用量筒规格为
A.10mL B.20mL C.50mL
③下列实验步骤中,正确的操作顺序应该是:
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌.
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸,冷却后沿玻璃棒注入容量瓶中;
D.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
E.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
F.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
④下列操作使所配溶液的物质的量浓度偏高的是
A.洗净容量瓶未干燥即用来配制溶液
B.用量筒量取浓硫酸时仰视观察凹液面.
C.未冷却到室温就将溶液转移到容量瓶并定容
D.往容量瓶中转移溶液时,有少量液体溅出.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据仪器的图形判断仪器的名称;
(2)带有活塞或旋塞的仪器要检查是否漏水;分液漏斗适用于两种互不相溶的液体的分离,分液用到烧杯、分液漏斗;四氯化碳与水不溶、密度大于水;
(3)①根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器的顺序;
浓H2SO4的物质的量浓度c=
,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;为减少误差选择略大于所需浓硫酸体积且规格相近的量筒;
②根据实验操作的步骤:量取、稀释、移液、洗涤、定容、摇匀等操作排序;
③分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
判断;
(2)带有活塞或旋塞的仪器要检查是否漏水;分液漏斗适用于两种互不相溶的液体的分离,分液用到烧杯、分液漏斗;四氯化碳与水不溶、密度大于水;
(3)①根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器的顺序;
浓H2SO4的物质的量浓度c=
| 1000ρw |
| M |
②根据实验操作的步骤:量取、稀释、移液、洗涤、定容、摇匀等操作排序;
③分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
| n |
| V |
解答:
解:(1)由仪器的图形可知C为冷凝管,D为分液漏斗.
故答案为:冷凝管;分液漏斗.
(2)带有活塞或旋塞的仪器要检查是否漏水,则题中分液漏斗和容量瓶应检漏;四氯化碳与水是互不相溶的两种液体,用分液的方法分离,分液用到烧杯、分液漏斗;四氯化碳与水不溶、密度大于水,所以四氯化碳在下层;
故答案为:BD,烧杯,下层;
(3)①配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)称量,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,需要使用的仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管等,
故选:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
②浓H2SO4的物质的量浓度为:c=
mol.L-1=18.4mol.L-1,配制240mL物质的量浓度为0.46mol.L-1的硫酸,需要选250mL的容量瓶,实际上配制的是250mL 0.46mol.L-1的硫酸溶液,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol.L-1=250mL×0.46mol.L-1,解得:x≈6.3,应选用10mL量筒;
故答案为:A,6.3mL
③配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,故答案为:ACBDFE;
④A.洗净容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都无影响,溶液浓度无影响,故A错误;
B.用量筒量取浓硫酸时仰视观察凹液面,溶质的物质的量偏大,溶液浓度偏大,故B正确;
C.未冷却到室温就将溶液转移到容量瓶并定容,溶液的体积偏小,溶液浓度偏大,故C正确;
D.往容量瓶中转移溶液时,有少量液体溅出,溶质的物质的量偏小,溶液浓度偏小,故D错误;
故选:BC;
故答案为:冷凝管;分液漏斗.
(2)带有活塞或旋塞的仪器要检查是否漏水,则题中分液漏斗和容量瓶应检漏;四氯化碳与水是互不相溶的两种液体,用分液的方法分离,分液用到烧杯、分液漏斗;四氯化碳与水不溶、密度大于水,所以四氯化碳在下层;
故答案为:BD,烧杯,下层;
(3)①配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)称量,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,需要使用的仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管等,
故选:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
②浓H2SO4的物质的量浓度为:c=
| 1000×1.84×98% |
| 98 |
故答案为:A,6.3mL
③配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,故答案为:ACBDFE;
④A.洗净容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积都无影响,溶液浓度无影响,故A错误;
B.用量筒量取浓硫酸时仰视观察凹液面,溶质的物质的量偏大,溶液浓度偏大,故B正确;
C.未冷却到室温就将溶液转移到容量瓶并定容,溶液的体积偏小,溶液浓度偏大,故C正确;
D.往容量瓶中转移溶液时,有少量液体溅出,溶质的物质的量偏小,溶液浓度偏小,故D错误;
故选:BC;
点评:本题考查了物质的分离、配制一定物质的量浓度的溶液的方法,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
化学与生活密切相关.下列生活中常见物质的俗名或名称与化学式相对应的是( )
| A、小苏打--Na2CO3 |
| B、烧碱--NaOH |
| C、甲醛--CH3OH |
| D、明矾--KAl(SO4)2 |
下列离子方程式正确的是( )
| A、向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ |
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3?H2O+SO2=NH4++HSO3- |
| D、向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2. |
下表中关于相关物质类型的描述全部正确的一组是( )
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 蔗糖 | Ba(OH)2 | CO2 |
| B | 聚乙烯 | 石膏 | CaCO3 | NH3 |
| C | 王水 | 冰 | H2SiO3 | Cl2 |
| D | 胆矾 | 玻璃 | H2SO3 | CH3CH2OH |
| A、A | B、B | C、C | D、D |
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”.中国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3的作用是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |