题目内容
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素.其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,Q在元素周期表的各元素中电负性最大.元素N的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
请回答下列问题:
(1)X元素的基态原子中电子占据 种能量不同的原子轨道,属于 区元素,它的外围电子排布图为 .
(2)XZ3分子的立体结构是 ,XZ2分子中中心原子的杂化类型为 ,两者中属于极性分子的是 (写分子式),请简述XZ3和XZ2对应水化物的酸性强弱差异的原因 .
(3)元素N的化合价最可能是 ;
(4)M与Q形成的化合物的沸点远高于Y与Q形成的化合物的原因是: .
| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(1)X元素的基态原子中电子占据
(2)XZ3分子的立体结构是
(3)元素N的化合价最可能是
(4)M与Q形成的化合物的沸点远高于Y与Q形成的化合物的原因是:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、N、Q为元素周期表前四周期的六种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素,依据元素N的气态原子逐个失去第1个至第3个电子所需能量能量较低,到失去第4个电子能量突然增高数倍,故N能形成+3价阳离子,为ⅢA族元素,据此解答各小题即可.
解答:
解:X、Y、Z、M、N、Q为元素周期表前四周期的六种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素,依据元素N的气态原子逐个失去第1个至第3个电子所需能量能量较低,到失去第4个电子能量突然增高数倍,故N能形成+3价阳离子,为ⅢA族元素,依据分析可知:X为硫、Y为碳、Z为氧、M为钙、N为ⅢA族元素、Q为氟,
(1)X为硫,S元素的基态原子中电子占据5种能量不同的原子轨道,属于p区元素,它的外围电子排布图为: ,
,
故答案为:5;p; ;
;
(2)XZ3为SO3,SO3分子中,中心原子硫原子最外层6个电子,外围有三个原子,所以不含有孤电子对,价层电子对个数=σ键个数+孤电子对个数=3+
(6-3×2)=3,且不含孤电子对,所以三氧化硫分子为平面三角形结构,SO2的价层电子对个数是3,所以硫原子采取sp2杂化,SO2呈V形,为极性分子,(HO)mSOn中n值越大,S元素的正电性越高,导致S-O-H中O的电子偏向S,因而在水分子的作用下也就越容易电离出H+,所以酸性H2SO4>H2SO3,故答案为:平面三角形;sp2杂化;SO2; (HO)mSOn中n值越大,S元素的正电性越高,导致S-O-H中O的电子偏向S偏移,因而在水分子的作用下也就越容易电离畜H+,酸性所以H2SO4>H2SO3;
(3)元素N处于第ⅢA族,故化合价最可能是+3,故答案为:+3;
(4)Ca与F形成的化合物的沸点远高于C与F形成的化合物的原因是:Ca2+和F-以离子键形成离子晶体,而CF4分子间以范德华力结合成分子晶体,离子键比范德华力强得多,故答案为:Ca2+和F-以离子键形成离子晶体,而CF4分子间以范德华力结合成分子晶体,离子键比范德华力强得多.
(1)X为硫,S元素的基态原子中电子占据5种能量不同的原子轨道,属于p区元素,它的外围电子排布图为:
 ,
,故答案为:5;p;
 ;
; (2)XZ3为SO3,SO3分子中,中心原子硫原子最外层6个电子,外围有三个原子,所以不含有孤电子对,价层电子对个数=σ键个数+孤电子对个数=3+
| 1 |
| 2 |
(3)元素N处于第ⅢA族,故化合价最可能是+3,故答案为:+3;
(4)Ca与F形成的化合物的沸点远高于C与F形成的化合物的原因是:Ca2+和F-以离子键形成离子晶体,而CF4分子间以范德华力结合成分子晶体,离子键比范德华力强得多,故答案为:Ca2+和F-以离子键形成离子晶体,而CF4分子间以范德华力结合成分子晶体,离子键比范德华力强得多.
点评:本题主要考查的是元素的推断,以此为载体重点涉及了核外价电子排布、分子结构判断、杂化类型判断,第一电离能等知识点,综合性较强,难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
 已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素).下列判断中正确的是( )| A、常温常压下,L是一种液态有机物 |
| B、E的二溴代物只有一种结构 |
| C、G具有强氧化性和漂白性 |
| D、上述反应的类型是加成反应 |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
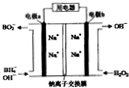 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |