题目内容
3.某氢氧化钠样品中测得其杂质含量为2%,取此种氢氧化钠60克,配制成300毫升溶液,其氢氧化钠的物质的量浓度为多少?分析 先求出样品中NaOH的质量,根据n=$\frac{m}{M}$,c=$\frac{n}{V}$计算.
解答 解:某氢氧化钠样品中测得其杂质含量为2%,取此种氢氧化钠60克,则m(NaOH)=60g×(1-2%)=58.8g,所以n(NaOH)=$\frac{58.8g}{40g/mol}$=1.47mol,则c(NaOH)=$\frac{1.47mol}{0.3L}$=4.9mol/L;
答:氢氧化钠的物质的量浓度为4.9mol/L.
点评 本题考查了物质的量的有关计算,题目难度不大,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,明确物质的量、质量与物质的量浓度的关系为解答关键.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
13.下列各实验中,可制得纯净产物的是( )
| A. | 乙烷和氯气在光照条件下反应制取氯乙烷 | |
| B. | 2-溴丁烷在氢氧化钠的醇溶液中加热制1-丁烯 | |
| C. | 1,3-丁二烯和溴水加成制取1,2-二溴丁烷 | |
| D. | 乙烯和氯化氢加成制取氯乙烷 |
14.下列有关有机物的说法正确的是( )
| A. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| B. | 等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由少到多 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
11.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,0.1mol乙跟足量的金属钠反应可得到氢气2.24L(标准状况),据此推断甲不可能是( )
| A. | HOCH2CH2CHO | |
| B. | 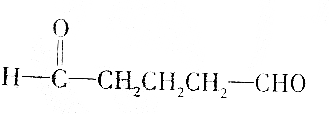 | |
| C. | 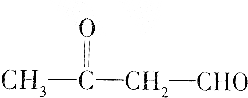 | |
| D. | 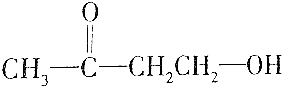 |
18.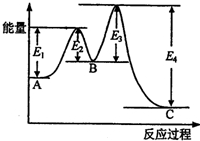 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 稳定性C>A>B | ||
| C. | A与C的能量差为E4 | D. | A?C反应,反应条件一定要加热 |
4.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
11.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 侯氏制碱法是先将CO2通入饱和NaCl溶液后,再通入NH3 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 | |
| D. | “神十”航天服是由碳化硅陶瓷和碳纤维复合而制成的,它是一种新型无机非金属材料 |
9.下列说法正确的是( )
| A. | 含有一个苯环,对位有两个不同的取代基,且取代基均为丁基的结构有6种 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物-定不相同 | |
| C. | 芳香族化合物A的分子式为C7H6O2,其中属于芳香族化食物的结构有4种 | |
| D. | 某有机物的结构简式为 ,该有机物通过消去反应脱去1 molHCl时,能得到6种不同产物(不考虑立体异构) ,该有机物通过消去反应脱去1 molHCl时,能得到6种不同产物(不考虑立体异构) |