题目内容
A、B、C是三种常用制备氢气的方法.
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ?mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
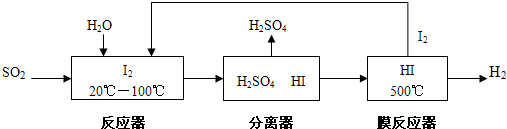
C.硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程制备H2:
回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据见下表(表中t1<t2):
保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (增大、减小、不变),H2O的体积分数 (增大、减小、不变);
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为 (吸热、放热)反应.
保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)= .
(2)写出方法B制备氢气的离子方程式:
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是 .
(4)反应:C(s)+CO2(g)=2CO(g),△H= .
A.煤炭制氢气,相关反应为:
C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ?mol-1
B.氯碱工业中电解饱和食盐水制备氢气.
C.硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程制备H2:

回答问题:
(1)某温度(T1)下,向容积为2L的密闭容器中充入一定量的CO和H2O,发生煤炭制氢气的一个反应:反应过程中测定的部分数据见下表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
保持其他条件不变,温度由T1升至T2,上述反应平衡常数为0.64,则正反应为
保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=
(2)写出方法B制备氢气的离子方程式:
(3)膜反应器常利用膜的特殊功能实现反应产物的选择性分离.方法C在HI分解反应中使用膜反应器分离出H2的目的是
(4)反应:C(s)+CO2(g)=2CO(g),△H=
考点:化学平衡的影响因素,热化学方程式
专题:基本概念与基本理论
分析:(1)保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大,自身转化率降低;
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,比较不同温度下的平衡常数大小判断反应的热效应;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)HI分解是可逆反应,分离出氢气有利于平衡正向移动;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,比较不同温度下的平衡常数大小判断反应的热效应;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)HI分解是可逆反应,分离出氢气有利于平衡正向移动;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答:
解:(1)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,则k=
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动,故正反应为放热反应;
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.40mol;
故答案为:增大; 增大; 放热; 0.40 mol;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(3)HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
故答案为:减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率;
(4)①C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ?mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ?mol-1
依据盖斯定律计算①-②得到:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ?mol-1;
故答案为:(a-b)kJ?mol-1;
t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算700℃时平衡常数,则k=
| 0.4×0.4 |
| 0.8×0.2 |
CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.40mol;
故答案为:增大; 增大; 放热; 0.40 mol;
(2)氯碱工业中电解饱和食盐水制备氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(3)HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
故答案为:减小氢气的浓度,使HI分解平衡正向移动,提高HI的分解率;
(4)①C(s)+H2O(g)?CO(g)+H2(g),△H=a kJ?mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g),△H=b kJ?mol-1
依据盖斯定律计算①-②得到:C(s)+CO2(g)=2CO(g),△H=(a-b)kJ?mol-1;
故答案为:(a-b)kJ?mol-1;
点评:本题主要考查化学反应速率、化学平衡及平衡常数等计算,电解原理分析,热化学方程式和盖斯定律计算应用,注意数据的规律分析利用,掌握基础是哦关键,题目难度中等.

练习册系列答案
相关题目
下列各组离子在水溶液中能大量共存,但用盐酸酸化后,不能大量共存的是( )
| A、Fe3+、K+、NO3-、SO42- |
| B、Al3+、Na+、HCO3-、SO42- |
| C、NO3-、K+、Al(OH)4-、HSO3- |
| D、Na+、K+、S2O32-、Cl- |
将100g CaCO3与一定量SiO2在高温下充分反应,产生的气体在标况下的体积为( )
| A、22.4㎡ |
| B、22.4L |
| C、11.2L |
| D、2.24L |
 2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献.
2007年诺贝尔化学奖授予德国科学家格哈德?埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献. (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示. ⑨CH≡CH.
⑨CH≡CH.