题目内容
4.用右图所示装置进行下列实验:将①中溶液逐滴滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |  |
| A | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
| C | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
| D | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀盐酸和碳酸钠反应先生成碳酸氢钠和氯化钠,生成的碳酸氢钠再和稀盐酸反应生成二氧化碳;
B.浓硝酸和Al发生钝化现象;
C.过氧化钠和水反应生成氧气,氧气能氧化氢氧化亚铁;
D.氢氧化钠和氧化铝反应生成偏铝酸钠.
解答 解:A.稀盐酸和碳酸钠反应先生成碳酸氢钠和氯化钠,生成的碳酸氢钠再和稀盐酸反应生成二氧化碳,所以不会立即产生气体,故A错误;
B.浓硝酸和Al发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以不会产生大量红棕色气体,故B错误;
C.过氧化钠和水反应生成氧气,氧气能氧化氢氧化亚铁,所以产生气体和红褐色沉淀,故C正确;
D.氢氧化钠和氧化铝反应生成可溶性的偏铝酸钠,溶液为澄清,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质之间的反应,明确物质性质是解本题关键,注意规律中的反常现象,易错选项是A,熟练掌握常见物质性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.根据表中八种短周期元素的有关信息判断,下列说法正确的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性小于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素④⑥形成的化合物具有两性 | |
| D. | 元素④⑥⑧的最高价氧化物的水化物两两之间皆能反应 |
15. NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
(1)前2s内的平均反应速率υ(N2)=2.08×10-4mol/(L•s)(保留3位有效数字,下同);计算此温度下该反应的K=3.65×106.
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
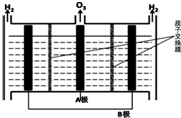
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
12.下列有关14C60的叙述正确的是( )
| A. | 与12C60化学性质相同 | B. | 与12C60互为同素异形体 | ||
| C. | 属于原子晶体 | D. | 与12C60互为同位素 |
19.根据元素周期律,由下列事实进行归纳推测,合理的是( )
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
9.甲、乙、丙、丁、戊均为短周期主族元素,甲的原子半径是第二周期中最小的;乙的单质能跟冷水剧烈反应产生氢气;丙原子核外p电子比s电子多5个;丁和丙在同周期,丁的最高价为+4价;戊的单质是气体,其密度介于H2和O2的密度之间.下列推断错误的是( )
| A. | 甲的非金属性最强 | |
| B. | 戊的最高价氧化物的水化物酸性最强 | |
| C. | 原子半径大小为:乙>丙>甲 | |
| D. | 乙分别与甲、丙形成晶体M、N的熔点大小为:M<N |
13.下列对有机反应类型的描述不正确的是( )
| A. | 乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 | |
| B. | 将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 | |
| C. | 乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应 |
14.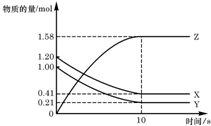 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到 10s,用 Z 表示的反应速率为 0.158mol/(L•s) | |
| B. | 反应开始到 10s,X 的物质的量浓度减少了 0.79mol/L | |
| C. | 反应开始到 10s,Y 的转化率为 79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |