题目内容
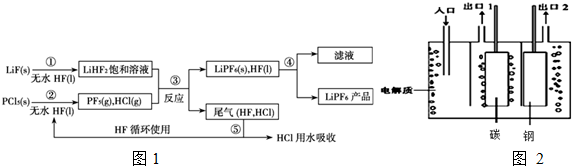
14. 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到 10s,用 Z 表示的反应速率为 0.158mol/(L•s) | |
| B. | 反应开始到 10s,X 的物质的量浓度减少了 0.79mol/L | |
| C. | 反应开始到 10s,Y 的转化率为 79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
分析 根据图象的曲线变化判断物质的量的变化以及反应速率、转化率的计算,根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.395mol/L,故B错误;
C.反应开始到10s时,Y的转化率为$\frac{1.0mol-0.21mol}{1.0mol}$×100%=79%,故C正确;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,
当反应进行到10s时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,
则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为X(g)+Y(g)?2Z(g),故D错误;
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.

练习册系列答案
相关题目
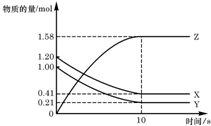
4.用右图所示装置进行下列实验:将①中溶液逐滴滴入②中,预测的现象与实际相符的是( )
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |  |
| A | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
| C | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
| D | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
19.在高温下,碘是紫红色蒸气,氢气、碘化氢是无色气体,在某容器中H2+I2?2HI+Q(高温)可逆反应达到平衡,请填写完整表.
| 改变条件 | 平衡移动方向 | 体系内混合气体的颜色变化 |
| (1)加入氢气 | 正反应方向 | 变浅 |
| (2)升高温度 | 逆反应方向 | 变深 |
| (3)加入碘 | 正反应方向 | 变深 |
| (4)使容器的容积压缩到原来的一半 | 不移动 | 变深 |
9.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结 论 |
| A | 将0.1mol•L-1 Na2CO3溶液稀释到0.01mol•L-1,测得pH变小 | 稀释后CO32-的水解程度减小 |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| A. | A | B. | B | C. | C | D. | D |
10.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 28 g聚乙烯中含有的碳原子数为2n NA | |
| C. | 常温常压下,0.2 g D216O中含有的质子数、中子数和电子数均为0.1NA | |
| D. | 6.8 g KHSO4晶体中含有0.1 NA个阳离子 |
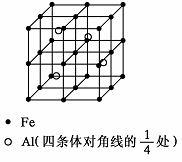 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.