题目内容
6.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3•5H2O晶体析出.该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质.为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.98 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
(2)根据上表数据分析,该样品A(填选项字母)
A.含有Na2S2O3、Na2SO3和Na2SO4三种成分
B.含有Na2S2O3和Na2SO3两种成分
C.只含有Na2S2O3
(3)求第三份样品中各成分的物质的量.
(4)求所加硫酸的物质的量浓度.
(5)若将63g该样品与一定量的该硫酸溶液微热,回答问题:
①欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位)硫酸溶液的体积.当a=0.06时,V(SO2)=5.6;
②(2分)在图1上画出b随a变化的曲线
(6)图2是实验室制取SO2并验证SO2的某些性质的装置图.
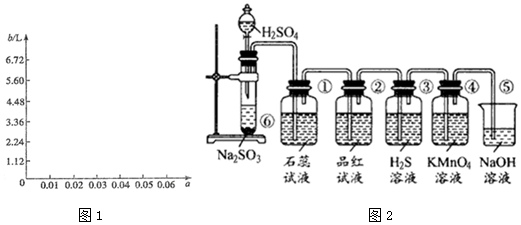
试回答:
Ⅰ.实验中应该选择浓硫酸,是否使用98%的浓H2SO4否(填“是”或“否”),写出⑥中反应化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑.
Ⅱ.①中的实验现象为变红.
Ⅲ.②中的现象证明SO2具有的化学性质为漂白性.
Ⅳ.③中的实验现象是变浑浊(生成淡黄色沉淀),证明SO2有氧化性.
Ⅴ.④中的实验现象是紫红色褪去,证明SO2有还原性.
Ⅵ.⑤的作用是吸收多余的SO2,防止污染空气.
分析 (1)样品中硫代硫酸钠与酸反应生成硫、二氧化硫与水;亚硫酸钠与酸反应生成二氧化硫与水;
(2)硫酸的体积一定,由表中数据可知,样品质量增大,硫的质量与二氧化硫的体积都增大,故第一、二组样品完全反应,酸有剩余,28.98g样品完全反应生成硫的质量为$\frac{28.98g}{12.6g}$×1.28g=2.944>2.56g,故第三组硫酸不足,样品完全反应.
以第一组计算判断:根据硫的质量计算根据硫的质量可求出硫代硫酸钠的物质的量、生成的二氧化硫的物质的量,在根据产生的二氧化硫的总的物质的量确定是否含有亚硫酸钠,利用总质量确定是否含有硫酸钠;
(3)根据(2)中的判断计算解答;
(4)由(2)中分析可知,第三份硫酸不足.由方程式知硫酸的物质的量即为反应生成二氧化硫的物质的量,据此计算硫酸的物质的量浓度;
(5)根据物质和酸之间的反应得到二氧化硫量的计算需要知道硫酸的体积,据此回答;
(6)Ⅰ.浓硫酸具有氧化性,能将亚硫酸根氧化,亚硫酸钠和硫酸反应生成硫酸钠、水以及二氧化硫;
Ⅱ.二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红;
Ⅲ.二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
Ⅳ、二氧化硫能把硫化氢氧化成淡黄色单质硫,本身被还原成淡黄色单质硫;
Ⅴ.酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性;
Ⅵ.氢氧化钠可以吸收多余的SO2,防止污染空气.
解答 解:(1)样品中硫代硫酸钠与酸反应生成硫、二氧化硫与水,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,亚硫酸钠与酸反应生成二氧化硫与水,离子方程式为:SO32-+2H+=SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;SO32-+2H+=SO2↑+H2O;
(2)硫酸的体积一定,由表中数据可知,样品质量增大,硫与二氧化硫的产量增大,故第一、二组样品完全反应,酸有剩余,28.98g样品完全反应可以硫的质量为$\frac{28.98g}{12.6g}$×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.
以第一组计算判断:1.28gS的物质的量为$\frac{1.28g}{32g/mol}$=0.04mol,由S2O32-+2H+=S↓+SO2↑+H2O可知,样品中硫代硫酸钠为0.04mol,该反应生成的二氧化硫为0.04mol,反应得到的二氧化硫总的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol>0.04mol,故含有Na2SO3,反应SO32-+2H+=SO2↑+H2O生成二氧化硫为0.05mol-0.04mol=0.01mol,由方程式可知,样品中Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g<12.6g,
故含有硫酸钠,即含有Na2S2O3、Na2SO3和Na2SO4三种成分,
故答案为:A;
(3)由(2)分析可知,12.6g样品中,含有硫代硫酸钠为0.04mol、Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g,故硫酸钠的质量为12.6g-11.18g=1.42g,物质的量为$\frac{1.42g}{142g/mol}$=0.01mol,
故12.6g样品中,含有硫代硫酸钠为0.04mol、Na2SO3为0.01mol,Na2SO4为0.01mol,
答:第三份样品中各成分的物质的量如下:硫代硫酸钠为0.04mol、Na2SO3为0.01mol,Na2SO4为0.01mol;
(4)由(2)中分析可知,第三份硫酸不足,硫酸完全反应.由S2O32-+2H+=S↓+SO2↑+H2O;SO32-+2H+=SO2↑+H2O可知,硫酸的物质的量即为反应生成二氧化硫的物质的量,故n(H2SO4)=n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,故该硫酸的物质的量浓度为$\frac{0.1mol}{0.02L}$=5mol/L,
答:所加硫酸的物质的量浓度是5mol/L.
(5)①硫酸溶液的体积a L(或a mL),设63 g样品中含x mol Na2SO3,则含Na2S2O3•5H2O为4x mol,Na2SO4x mol,则有:248×4x+126x+142x=63,x=0.05 mol
当a=<A0.05 时,V(SO2)=5.6L,当a=0.06时,V(SO2)不再改变,仍等于5.6L,故答案为:硫酸溶液的体积;5.6;
②根据上述计算,b随a变化的曲线如下: ,故答案为:
,故答案为: ;
;
(6)Ⅰ.浓硫酸具有氧化性,能将亚硫酸根氧化,亚硫酸钠和硫酸反应生成硫酸钠、水以及二氧化硫Na2SO3+H2SO4=Na2SO4+H2O+SO2,故答案为:否;Na2SO3+H2SO4=Na2SO4+H2O+SO2;
Ⅱ.二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:变红;
Ⅲ.二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,故答案为:漂白性;
Ⅳ、SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成淡黄色单质硫,本身被还原成淡黄色单质硫,反应方程式为SO2+2H2S=3S↓+2H20,
故答案为:变浑浊(生成淡黄色沉淀);氧化;
Ⅴ.酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性,二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:紫红色褪去;还原;
Ⅵ.氢氧化钠作用是吸收多余的SO2,防止污染空气,故答案为:吸收多余的SO2,防止污染空气.
点评 本题考查了含有硫元素的物质的性质的实验设计和性质分析判断,注意掌握二氧化硫酸性氧化物性质、漂白性、氧化性和还原性等是解题关键,题目难度中等.

_____MnO4-____H2O2+_____H+=____ Mn2++_____O2↑+_____H2O
下列说法错误的是( )
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
| A. | 钢笔的笔头不易被氧化,抗腐蚀性能好 | |
| B. | 铱金笔的耐磨性能比钢笔好 | |
| C. | 金笔的笔头和笔尖都是用纯金制成的 | |
| D. | 金笔经久耐磨,是一种很理想的硬笔 |
| A. | 应量取的浓盐酸的体积是10.0mL | |
| B. | 若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 | |
| C. | 量取浓盐酸时,因浓盐酸有挥发性,所以要多量取lmL浓盐酸 | |
| D. | 定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补至刻度线 |
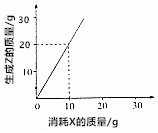
| A. | 有4g Z生成时,则消耗Y 3g | B. | X、Y、Z的摩尔质量之比为1:1:2 | ||
| C. | X、Y、Z的摩尔质量之比为2:3:2 | D. | X、Y、Z的摩尔质量之比为3:2:6 |
| A. | Cl2 | B. | H2S | C. | NH3 | D. | HCl |
 的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是
的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是 .
.