题目内容
13.硫及其主要的化合物在化学研究及生产生活中都有重要的应用.(1)硫的气态氢化物H2S是一种臭鸡蛋气味的气体,写出它的电子式
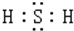 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.(2)硫单质在一定条件下能与硫化钠反应分别生成多硫化钠(与Na2O2结构相似),反应方程式为:Na2S+(x-1)S=Na2Sx
①Na2Sx中所合化学键的类型有离子键、非极性共价键.
②已知向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气昧的气体生成,写出发生反应的离子方程式:Sx2-+2H+=H2S↑+(x-1)S↓
(3)硫代硫酸钠(Na2S2O3)俗名叫大苏打,在中学化学实验中利用它和稀硫酸的反应探究温度对化学反应速率的影响.
①写出Na2S2O3与稀硫酸反应的化学方程式:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.
②S2O32-有很强的配位能力,照相底片上未曝光的溴化银在定影液(含Na2S2O3)中由于形成一个配位数为2的配离子而溶解,该配离子的化学式为:[Ag(S2O3)2]3-
(4)锅炉水垢中的硫酸钙因难溶于酸而很难清洗,通常采取的方法为先用饱和碳酸钠溶液处理,再用稀盐酸除去;写出用饱和碳酸钠溶液处理时发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-.
分析 (1)H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,通过H2S与氧气发生的反应中化合价的变化分析H2S表现的性质;
(2)①Na2O2中含有离子键和非极性共价键,Na2Sx与Na2O2结构相似;
②溶液变浑浊,说明有S生成,且有臭鸡蛋气昧的气体生成,说明H2S生成;
(3)①Na2S2O3与稀硫酸反应生成硫酸钠、二氧化硫、硫和水;
②该配离子的中心离子为银离子,配体为S2O32-,配位数为2,以此写出配离子的化学式;
(4)饱和碳酸钠溶液与硫酸钙反应生成碳酸钙和硫酸钠,难溶物写化学式.
解答 解:(1)H2S的电子式与H2O的相似,硫原子中最外层有8个电子达到稳定结构,电子式为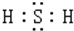 ,
,
H2S的水溶液在空气中放置时,会逐渐变浑浊,发生的反应为2H2S+O2=2S↓+2H2O,硫元素化合价升高,H2S表现还原性,
故答案为: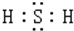 ;还原;
;还原;
(2)①Na2Sx与Na2O2结构相似,Na2O2中含有离子键和非极性共价键,因此Na2Sx中所合化学键的类型有离子键和非极性共价键,
故答案为:离子键、非极性共价键;
②向多硫化钠溶液中滴加稀盐酸,溶液变浑浊,且有臭鸡蛋气昧的气体生成,说明有S和H2S生成,离子方程式为Sx2-+2H+=H2S↑+(x-1)S↓,
故答案为:Sx2-+2H+=H2S↑+(x-1)S↓;
(3)①Na2S2O3与稀硫酸反应生成硫酸钠、二氧化硫、硫和水,化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,
故答案为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O;
②该配离子的中心离子为银离子,配体为S2O32-,配位数为2,配离子的化学式为[Ag(S2O3)2]3-,
故答案为:[Ag(S2O3)2]3-;
(4)碳酸钙比硫酸钙更难溶,饱和碳酸钠溶液与硫酸钙反应生成碳酸钙和硫酸钠,离子方程式为CaSO4+CO32-=CaCO3+SO42-,
故答案为:CaSO4+CO32-=CaCO3+SO42-.
点评 本题考查了硫及其主要的化合物的结构和性质,侧重于化学方程式或离子方程式的书写,难度中等,注意反应物有难溶物时,生成的难溶物不能写沉淀符号.

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
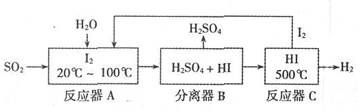
高效智能课时作业系列答案 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )| A. | W、与X、Y、Z形成的化合物均是共价化合物 | |
| B. | 简单离子半径:Z>Y>X | |
| C. | X、Y、Z形成的化合物水溶液一定呈碱性 | |
| D. | X、Y形成的化合物一定含有离子键 |
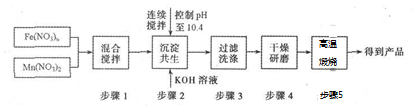
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀4.46g
(2)另一份固体溶于水,与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况),并得到沉淀,沉淀经洗涤、灼烧,最终获得1.6g红色固体.下列说法正确的是( )
| A. | 该固体中一定含有NH4+、Cl-、SO42-、Na+ | |
| B. | 根据以上实验,无法确定该固体中有Cl- | |
| C. | 该固体中只含有NH4+、Fe3+、SO42-、Cl- | |
| D. | 该固体中一定没有I-、CO32- |
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | H2CO3 | HClO |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3×10-8 |
| A. | lmolCl2通入足量的水中充分反应,转移的电子数约为6.02×1023 | |
| B. | 将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O | |
| C. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值不变 | |
| D. | 向浓度均为1×103 mol/L-1的KC1和K2CrO4混合溶液中滴加1×10-3 mol/L-1的AgNO3溶液Cl-先沉淀 |
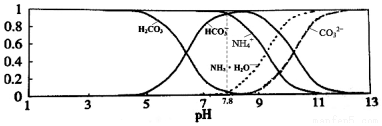
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
| A. | SCN- | B. | CO32- | C. | Cl- | D. | OH- |
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 利用减压过滤的方法可以用来快速分离、提纯蛋白质 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
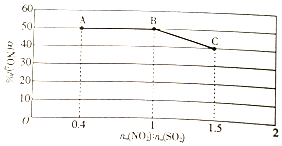 已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).
已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).