题目内容
2.已知某溶液中存在NH4+、Ba2+、Fe3+三种阳离子,则其中可能大量存在的阴离子是( )| A. | SCN- | B. | CO32- | C. | Cl- | D. | OH- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质、络离子等,则离子大量共存,以此来解答.
解答 解:A.SCN-、Fe3+结合生成络离子,不能共存,故A不选;
B.Ba2+、Fe3+均与CO32-结合生成沉淀,不能共存,故B不选;
C.均与氯离子不反应,可大量共存,故C选;
D.NH4+、Fe3+均与OH-反应生成弱碱,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、络合反应的判断,题目难度不大.

练习册系列答案
相关题目
2.用CH4还原NO2可以消除氮的氧化物对环境的污染,热化学方程式如下:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ•mol-1下列说法错误的是( )
| A. | CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H<-867.0 KJ•mol-1 | |
| B. | 若增加甲烷的用量,平衡后体系中CO2的百分含量不一定升高 | |
| C. | 使用催化剂,可以降低反应的活化能,减少反应所放出的热量 | |
| D. | 标准状况下4.48 L CH4参加反应,转移电子数为1.6 NA |
10.Na2CO3(aq)与盐酸反应过程中的能量变化示意图如图,下列选项正确的是( )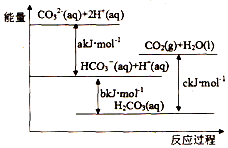

| A. | H2CO3(aq)=CO2(g)+H2O(l)为放热反应 | |
| B. | CO32-(aq)+H+(aq)=HCO3-(aq)△H=akJ/mol | |
| C. | HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)△H=(c-b)kJ/mol | |
| D. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(a+b-c)kJ/mol |
17.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法正确的是( )
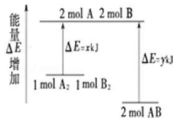

| A. | 该反应是吸热反应 | |
| B. | 断裂 1molA-A 键和 1mol B-B 键放出 xkJ 能量 | |
| C. | 断裂 2molA-B 键需要吸收 y kJ 的能量 | |
| D. | 1molA2和 1molB2 的总能量低于 2molAB 的总能量 |
7.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入 AgNO3溶液,再加入稀 HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入 NaOH 溶液共热,然后加入稀 HNO3使溶液呈酸性,再滴入 AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入 NaOH 溶液共热,冷却后加入 AgNO3溶液,观察有无浅黄色沉淀生成 |
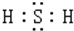 ,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
,H2S的水溶液在空气中放置时,会逐渐变浑浊,这说明还H2S有强的还原性.
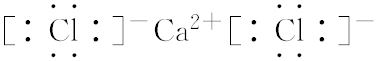 .
. ,棕黄色
,棕黄色 .
.