题目内容
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 .
(3)已知:
分析上表中四种物质的相关数据,请回答:
①NH3和PH3比较,沸点高低的原因是 .
②CH4和SiH4比较,分解温度高低的原因是 .
③结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 先液化.
(1)砷原子核外电子排布式为
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①NH3和PH3比较,沸点高低的原因是
②CH4和SiH4比较,分解温度高低的原因是
③结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
考点:原子核外电子排布,判断简单分子或离子的构型,晶体熔沸点的比较
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)As是33号元素,其原子核外有33个电子,根据构造原理书写其基态原子核外电子排布式;
(2)含有孤电子对和含有空轨道的原子之间易形成配位键;
(3)①NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点;
②键长越短,键能越大,越稳定;
③一定压强下,沸点高的气体先液化.
(2)含有孤电子对和含有空轨道的原子之间易形成配位键;
(3)①NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点;
②键长越短,键能越大,越稳定;
③一定压强下,沸点高的气体先液化.
解答:
解:(1)As是33号元素,其原子核外有33个电子,根据构造原理知,As基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,因为CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道),所以二者之间存在配位键,故答案为:配位键;原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)①NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点,所以NH3和PH3比较,氨气中含有氢键沸点大,
故答案为:NH3分子间存在氢键作用,因此NH3的沸点高于PH3;
②由键长越短,键能越大,越稳定,分解温度就越高可知,分解破坏的均为共价键,C-H的键能大于Si-H的键能,所以甲烷的分解温度高于硅烷,
故答案为:C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;
③一定压强下,沸点高的气体先液化,HF分子之间存在氢键,沸点高,则HF和HCl的混合气体降温时HF先液化,
故答案为:HF.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,因为CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道),所以二者之间存在配位键,故答案为:配位键;原因是CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)①NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点,所以NH3和PH3比较,氨气中含有氢键沸点大,
故答案为:NH3分子间存在氢键作用,因此NH3的沸点高于PH3;
②由键长越短,键能越大,越稳定,分解温度就越高可知,分解破坏的均为共价键,C-H的键能大于Si-H的键能,所以甲烷的分解温度高于硅烷,
故答案为:C-H键键能大于Si-H键,因此CH4分解温度高于SiH4;
③一定压强下,沸点高的气体先液化,HF分子之间存在氢键,沸点高,则HF和HCl的混合气体降温时HF先液化,
故答案为:HF.
点评:本题考查了物质结构和性质,涉及配位键、原子核外电子排布式的书写、物质沸点高低的判断等知识点,这些都是考试热点,注意氢键对物质性质的影响为易错点,题目难度不大.

练习册系列答案
相关题目
下列有机反应表达错误的是( )
A、CH4+Cl2
| |||
| B、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
C、
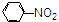 | |||
D、nCH2=CH2
 |
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2HI(g)?I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L.改变相关条件,下列结论正确的是( )
| A、保持容器体积不变,升高温度,混合气体的颜色逐渐变深 |
| B、恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C、恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L |
| D、恒温、恒压,再通入2mol HI气体,到达平衡状态后,HI转化率会提高 |
 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛. ,其分子式为
,其分子式为