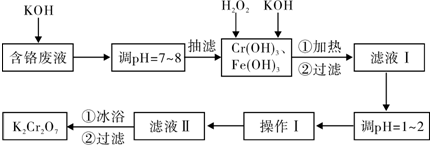
题目内容
按要求填空:
(1)钾元素的基态原子简化电子排布式为 ,位于元素周期表中第 周期、 族.
(2)基态原子简化电子排布式为[Ar]3d34s2的元素位于元素周期表中第 周期、 族.
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素符号是 ,位于元素周期表中第 周期、 族.
(4)基态原子简化电子排布式为[Ne]3s23p5的元素位于元素周期表中第 周期、 族,最高价氧化物对应的水化物的化学式是 ,最低化合价是 .
(1)钾元素的基态原子简化电子排布式为
(2)基态原子简化电子排布式为[Ar]3d34s2的元素位于元素周期表中第
(3)基态原子的电子排布式为1s22s22p63s23p63d104s1的元素符号是
(4)基态原子简化电子排布式为[Ne]3s23p5的元素位于元素周期表中第
考点:原子核外电子排布
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:(1)钾元素核外有19个电子,根据构造原理书写;根据电子层数和最外层电子数确定在周期表中位置;
(2)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;
(3)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;
(4)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;根据化合价写最高价氧化物对应的水化物.
(2)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;
(3)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;
(4)根据元素的电子排布式确定电子层数和最外层电子数,然后确定在周期表中位置;根据化合价写最高价氧化物对应的水化物.
解答:
解:(1)钾元素核外有19个电子,根据构造原理书写出基态原子简化电子排布式为:[Ar]4s1;钾核外有4个电子层,最外层电子数为1,位于第四周期第IA族;
故答案为:[Ar]4s1;四;ⅠA;
(2)根据基态原子简化电子排布式为[Ar]3d34s2可知,该元素原子核外有4个电子层,最外层为5,为钒元素,所以位于第四周期第VB族;
故答案为:四;ⅤB;
(3)已知基态原子的电子排布式为1s22s22p63s23p63d104s1,则该元素原子核外有29个电子为Cu元素,所以位于第四周期第ⅠB族;
故答案为:Cu;四;ⅠB;
(4)基态原子简化电子排布式为[Ne]3s23p5,则该元素原子核外有17个电子为氯元素,所以位于第三周期第ⅦA族;氯元素的最高价为+7价,其最高价氧化物对应的水化物的化学式是HClO4,氯元素的最低价为-1价;
故答案为:三;ⅦA;HClO4;-1.
故答案为:[Ar]4s1;四;ⅠA;
(2)根据基态原子简化电子排布式为[Ar]3d34s2可知,该元素原子核外有4个电子层,最外层为5,为钒元素,所以位于第四周期第VB族;
故答案为:四;ⅤB;
(3)已知基态原子的电子排布式为1s22s22p63s23p63d104s1,则该元素原子核外有29个电子为Cu元素,所以位于第四周期第ⅠB族;
故答案为:Cu;四;ⅠB;
(4)基态原子简化电子排布式为[Ne]3s23p5,则该元素原子核外有17个电子为氯元素,所以位于第三周期第ⅦA族;氯元素的最高价为+7价,其最高价氧化物对应的水化物的化学式是HClO4,氯元素的最低价为-1价;
故答案为:三;ⅦA;HClO4;-1.
点评:本题考查了核外电子排布规律、元素在周期表位置的判断,难度不大,理解核外电子排布规律是关键,注意电子排布式与电子排布图的区别.

练习册系列答案
相关题目
一定条件反应N2+3H2?2NH3△H<0达平衡,当单独改变下述条件后,有关叙述错误的是( )
| A、加催化剂,V正和V逆都发生变化,且变化的倍数相等 |
| B、增大压强,V正和V逆都增大,且V正增加倍数大于V逆增加倍数 |
| C、降低温度,V正和V逆都减少,且V逆减少倍数大于V正减少倍数 |
| D、通入氩气,V正和V逆都增大,且V正增加倍数大于V逆增加倍数 |
下列有关说法错误的是( )
| A、油脂的种类很多,但它们水解后都一定有一产物相同 | ||
| B、淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体 | ||
C、已知CH4+H2O
| ||
| D、C(CH3)4的二氯代物只有2种 |