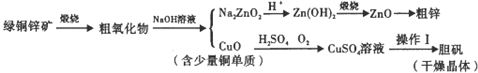
题目内容
10. 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是c.
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
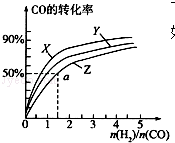
(2)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
①在图中三条曲线,对应的温度由高到低的顺序是Z>Y>X.
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g)═CO(g)+2H2(g)的平衡常数:K=0.25.
(3)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I>Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I<Ⅱ.
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为45%.
分析 (1)升高温度、增大压强、使用催化剂等均可加快反应速率,结合平衡移动原理分析解答;
(2)①合成甲醇是放热反应,温度升高,CO的转化率降低;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
变化量(mol) 1 2 1
平衡量(mol) 1 1 1
再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,相同温度下CH3OH(g)═CO(g)+2H2(g)的平衡常数与 CO(g)+2H2(g)?CH3OH(g)的平衡常数互为倒数;
(3)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,Ⅱ中平衡等效再I中平衡基础上增大压强,平衡正向移动;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,利用差量法计算参加反应CO的物质的量,进而计算CO转化率.
解答 解:(1)a.随时将CH3OH与反应混合物分离,减小生成物的浓度,利于反应正向进行,但反应速率减小,故a错误;
b.反应是放热反应,温度降低,利于反应正向进行,但反应速率变小,故b错误;
c.正反应为气体积减小的反应,压强增大,利于反应正向进行,反应速率加快,故c正确;
d.使用催化剂,反应速率加快,不影响化学平衡移动,故d错误;
故选:c;
(2)①反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,CO转化率越低,所以曲线Z对应的温度最高,X对应的一氧化碳转化率最大,温度最低,Y介于二者之间,在图中三条曲线,对应的温度由高到低的顺序是Z>Y>X;
故答案是:Z>Y>X;
②a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,图象中可知,起始量氢气物质的量n(H2)=1.5n(CO)=3mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
变化量(mol) 1 2 1
平衡量(mol) 1 1 1
容器容积为2L,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4,相同温度下CH3OH(g)═CO(g)+2H2(g)的平衡常数=$\frac{1}{4}$=0.25,
故答案为:0.25;
(4)①恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中,正反应为气体体积减小的反应,随反应进行气体物质的量减小,I中压强减小,压强越大反应速率越快,达到平衡需要的时间短,故达到平衡所需时间Ⅰ>Ⅱ;
Ⅱ中平衡等效再I中平衡基础上增大压强,平衡正向移动,所以两容器中CH3OH的体积分数Ⅰ<Ⅱ;
故答案为:>;<;
②平衡时,测得容器Ⅰ中的压强减小了30%,气体物质的量减小30%,即减少(1+2)mol×30%=0.9mol,则:
CO(g)+2H2(g)?CH3OH(g)物质的量减小△n
1 2
0.45mol 0.9mol
则该容器中CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、化学反应速率影响因素、化学平衡常数等知识,是对学生综合能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
I.双氧水氧化法除NaCN
(1)NaCN的电子式为
 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.
| A. | 3:4 | B. | 1:2 | C. | 1:4 | D. | 3:2 |
 室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | 稀释前两溶液的Ka:MOH溶液>ROH溶液 | |
| B. | ROH的电离程度:b点小于a点 | |
| C. | 两溶液在稀释过程中,c(H+)均逐渐减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
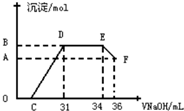 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
| A. | 加热氯酸钾 | B. | 加热氯酸钾和二氧化锰 | ||
| C. | 加热高锰酸钾 | D. | 加热双氧水 |
| A. |  | B. |  | C. |  | D. |  |
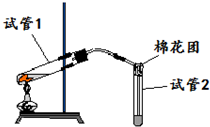 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题: