题目内容
18.氯的原子序数为3517Cl是氯的一种同位素,下列说法正确的是( )| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5g35Cl2气体的体积约为1.12L | |
| D. | 35Cl2气体的摩尔质量为70 |
分析 A.35Cl是氯的一种同位素,质子数等于原子序数;
B.根据质量数=质子数+中子数计算分子中各原子的中子数,计算出1个分子含有的中子数,在根据N=nNA计算;
C.不一定处于标准状况,不能使用气体摩尔体积22.4L/mol;
D.摩尔质量为的单位为g/mol.
解答 解:A.35Cl是氯的一种同位素,质子数等于原子序数,所以35Cl质子数为17,中子数为35-17=18,故A错误;
B.1H35Cl分子所含中子为18,$\frac{1}{18}$mol的1H35Cl分子所含中子的物质的量为1mol,所以中子数约为6.02×1023,故B正确;
C.氯气不一定处于标准状况,不能使用气体摩尔体积22.4L/mol,故C错误;
D.摩尔质量为的单位为g/mol等,故D错误.
故选B.
点评 本题考查同位素、常用化学计量数的有关计算等,难度不大,注意气体摩尔体积使用条件与范围.

练习册系列答案
相关题目
9.下列方法中不能用来区别NaNO2和NaCl的是( )
| A. | 测定这两种溶液的pH值 | B. | 在酸性条件下加入KI淀粉溶液 | ||
| C. | 观察二者的颜色 | D. | 用AgNO3和HNO3两种试剂来区别 |
6.若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生5.6L (己换算成标准状况)NO和NO2的混合气体,则所消耗硝酸的物质的量是( )
| A. | 0.25mol | B. | 0.2mol | C. | 0.45mol | D. | 0.65mol |
13.下列关于影响化学反应速率的条件的说法正确的是( )
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 化学反应中,反应物所处的状态对反应速率没有影响 | |
| C. | 化学反应速率改变,化学平衡一定会发生移动 | |
| D. | 升高温度,一定能加快化学反应速率 |
3.下列措施对增大反应速率明显有效的是( )
| A. | 钾与水反应时增大水的用量 | |
| B. | 铝与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 实验室制取二氧化碳时,将块状大理石改为粉状大理石 |
10.下列说法正确的是( )
| A. | 将纯水加热,其KW增大而PH不变 | |
| B. | 常温下,PH=6的溶液一定是酸溶液 | |
| C. | 25℃时,0.1mol/的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 向氨水中加入氯化铵固体会使溶液的pH增大 |
7.根据如图回答,下列说法不正确的是( )
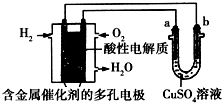

| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度不变 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
8.下列事实能说明氯气与水的反应是可逆反应的是( )
| A. | 氯水的漂白作用 | B. | 氯水呈黄绿色 | ||
| C. | 氯水与NaOH反应 | D. | 氯水与锌反应产生H2 |
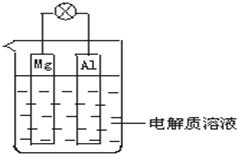 如图所示,试回答下列问题 (灯泡功率合适):
如图所示,试回答下列问题 (灯泡功率合适):