题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、水电离出的c(H+)?c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32- |
| B、澄清透明溶液:Mg2+、Cu2+、Cl-、SO42- |
| C、使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3- |
| D、含0.1mol?L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:A.水电离出的c(H+)?c(OH-)=10-22的溶液,水的电离程度减小,该溶液为酸性或碱性溶液,S2O32-能够与氢离子反应;
B.Mg2+、Cu2+、Cl-、SO42-之间不发生反应,且为澄清透明溶液;
C.使酚酞变红色的溶液为碱性溶液,铵根离子能够与氢氧根离子、偏铝酸根离子反应;
D.铁离子能够将碘离子氧化成碘单质.
B.Mg2+、Cu2+、Cl-、SO42-之间不发生反应,且为澄清透明溶液;
C.使酚酞变红色的溶液为碱性溶液,铵根离子能够与氢氧根离子、偏铝酸根离子反应;
D.铁离子能够将碘离子氧化成碘单质.
解答:
解:A.该溶液为酸性或者碱性溶液,在酸性溶液中,S2O32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Mg2+、Cu2+、Cl-、SO42-之间反应,溶液为澄清透明溶液,在溶液中能够大量共存,故B正确;
C.该溶液为碱性溶液,NH4+能够与AlO2-、OH-发生反应,在溶液中不能大量共存,故C错误;
D.Fe3+能够与KI发生反应,在溶液中不能大量共存,故D错误;
故选B.
B.Mg2+、Cu2+、Cl-、SO42-之间反应,溶液为澄清透明溶液,在溶液中能够大量共存,故B正确;
C.该溶液为碱性溶液,NH4+能够与AlO2-、OH-发生反应,在溶液中不能大量共存,故C错误;
D.Fe3+能够与KI发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评:本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
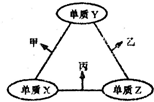 x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )| A、X元素位于第ⅣA族 |
| B、热稳定性:乙<丙 |
| C、甲和丙可能发生氧化还原反应 |
| D、分子乙中各原子均达8电子稳定结构 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是( )
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
下列说法正确的是( )
| A、常温常压下,16g O3含有NA个O3 |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 |
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是( )
| A、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 | ||
B、
| ||
| C、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | ||
| D、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol N2与足量的H2反应,转移的电子数是0.6NA |
| B、常温下,0.1mol?L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C、常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA |
| D、2.24L CO和CO2的混合气体中所含的碳原子数为0.1N A |
能正确表示下列反应的离子方程式的是( )
A、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| B、0.01mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:A13++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
| C、少量二氧化硫通入次氯酸钠碱性溶液中:SO2+ClO-+2OH-═SO42-+Cl-+H2O | ||||
| D、Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O |
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L?min) |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为60% |
| D、实验④中,达到平衡时,b>0.060 |