题目内容
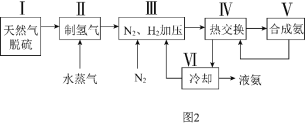
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
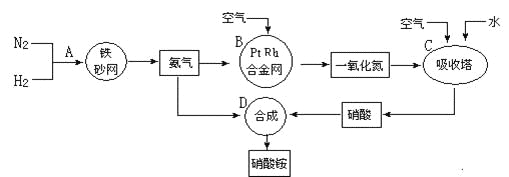
(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
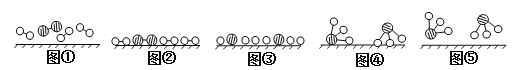
![]() 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
【答案】氧化炉 4NH3+5O2 4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2中化学键断裂 利用余热,节约能源 可使NO循环利用,全部转化成HNO3 NH3还原法 53
4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2中化学键断裂 利用余热,节约能源 可使NO循环利用,全部转化成HNO3 NH3还原法 53
【解析】
(1)在工业制硝酸的生产中,氨的催化氧化在氧化炉中进行,故B设备的名称是氧化炉,发生反应的化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(2)分析工艺流程知此生产过程中,N2与H2合成NH3所用的催化剂是铁砂网(或铁);分析图示知图②和图③的含义分别是N2、H2被吸附在催化剂表面、N2、H2中化学键断裂。
(3)合成氨的反应为放热反应,在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源;在合成硝酸的吸收塔中通入空气的目的是可使NO循环利用,全部转化成HNO3。
(4)碱液吸收法中,只有当NO和NO2的物质的量之比小于等于1:1时尾气才能吸收完全,且生成物亚硝酸钠有毒,而NH3还原法生成物为氮气和水,对环境无影响,故两种方法中,符合绿色化学的是NH3还原法。
(5)设生产硝酸的NH3的物质的量为1mol,根据关系式:NH3~HNO3和题给信息计算生成HNO3的物质的量为:1 mol×96%×92%=0.88 mol;根据反应:NH3+HNO3=NH4NO3知与硝酸反应的NH3的物质的量为0.88mol,故制HNO3用去NH3的质量占总消耗NH3的质量分数为:![]() ×100%=53%。
×100%=53%。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】资料显示“![]() 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究![]() 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。

供选试剂:![]() 溶液、
溶液、![]() 固体、
固体、![]() 固体。
固体。
该小组同学设计![]() 、
、![]() 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 向Ⅰ试管中加入 Ⅱ试管中加入适量 | Ⅱ试管中有气泡冒出,溶液变蓝 |
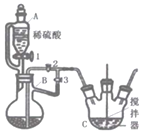
(1)选择Ⅰ装置用![]() 固体制取
固体制取![]() ,为避免
,为避免![]() 固体随
固体随![]() 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________,![]() 组实验中
组实验中![]() 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比![]() 、
、![]() 两组实验可知,
两组实验可知,![]() 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与![]() 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | 溶液略变蓝 |
| 向Ⅰ试管中加入 | 无明显变化 |
对于实验![]() 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“![]() 时
时![]() 不能氧化
不能氧化![]() ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
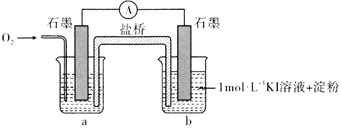
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入![]() 后________。
后________。
(iii)小刚同学向![]() 的KOH溶液
的KOH溶液![]() 含淀粉
含淀粉![]() 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有![]() ,褪色的原因是________
,褪色的原因是________![]() 用离子方程式表示
用离子方程式表示![]() 。
。
(4)该小组同学对实验过程进行了反思:实验![]() 的现象产生的原因可能是________。
的现象产生的原因可能是________。