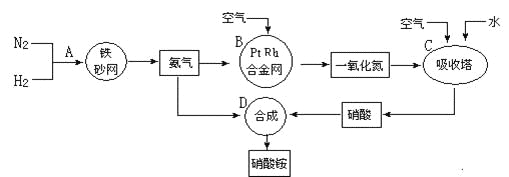
题目内容
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
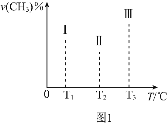
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
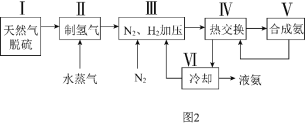
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
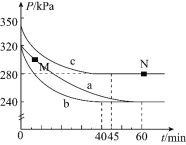
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
【答案】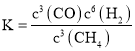 Ⅲ 大于 高温 D
Ⅲ 大于 高温 D ![]()
![]()
![]() 使用催化剂 增大压强
使用催化剂 增大压强 ![]() 增大
增大
【解析】
Ⅰ固相和气相均存在的反应,固相的浓度项不列入化学平衡常数表达式;根据图中Ⅰ、Ⅱ、Ⅲ图象,![]() 百分含量随温度的变化解答;根据温度对平衡的影响来判断,升高温度平衡正向移动,
百分含量随温度的变化解答;根据温度对平衡的影响来判断,升高温度平衡正向移动,![]() 的含量增大,据此判断
的含量增大,据此判断![]() 大小,再由焓变和熵变判断反应自发进行的条件;
大小,再由焓变和熵变判断反应自发进行的条件;
Ⅱ在一定条件下,反应I达到最大反应限度时,说明反应达到化学平衡,各组分浓度不再改变,体系压强不再改变,正逆反应速率相等,据此逐项分析;根据反应Ⅰ和反应Ⅱ推导所求反应,由多重平衡规则计算该反应的化学平衡常数;
![]() 根据
根据![]() 计算
计算![]() 的消耗速率,根据转化率
的消耗速率,根据转化率![]() 计算
计算![]() 的平衡转化率
的平衡转化率![]() ;与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,实验c的压强大于实验a的压强;实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,N点达到化学平衡状态,再加入一定量
;与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,实验c的压强大于实验a的压强;实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,N点达到化学平衡状态,再加入一定量![]() ,促使化学平衡正向移动。
,促使化学平衡正向移动。
Ⅰ(1) ①固相和气相均存在的反应,固相的浓度项不列入化学平衡常数表达式,该反应的化学平衡常数表达式为: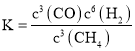 ;
;
故答案为: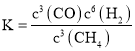 ;
;
![]() 在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入
在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入![]() ,
,![]() ,根据图中Ⅰ、Ⅱ、Ⅲ图象,温度逐渐升高,三个容器中的
,根据图中Ⅰ、Ⅱ、Ⅲ图象,温度逐渐升高,三个容器中的![]() 百分含量没有呈整体上升的趋势,则其中肯定有一个达到了平衡,温度升高,反应速率加快,可知先达到平衡的是容器III前两个容器没有达到平衡,且随温度升高,
百分含量没有呈整体上升的趋势,则其中肯定有一个达到了平衡,温度升高,反应速率加快,可知先达到平衡的是容器III前两个容器没有达到平衡,且随温度升高,![]() 百分含量下降,可知升高温度平衡正向进行,反应
百分含量下降,可知升高温度平衡正向进行,反应![]() 的
的![]() 大于0,反应气体分子数增多,熵增,即
大于0,反应气体分子数增多,熵增,即![]() ,反应放热,
,反应放热,![]() ,所以反应在高温下自发;
,所以反应在高温下自发;
故答案为:Ⅲ;大于;高温;
Ⅱ(1) ①单位时间内1mol![]() 消耗,必然同时有3mol
消耗,必然同时有3mol![]() 生成,说明反应正向进行,并不能说明反应已经达到化学平衡,故A错误;
生成,说明反应正向进行,并不能说明反应已经达到化学平衡,故A错误;![]() 、
、![]() 、CO的物质的量浓度关系取决于反应物的充入量以及反应进行的程度,并不能通过三者物质的量浓度相等说明反应达到化学平衡,故B错误;混合气体的密度为
、CO的物质的量浓度关系取决于反应物的充入量以及反应进行的程度,并不能通过三者物质的量浓度相等说明反应达到化学平衡,故B错误;混合气体的密度为![]() ,反应前后质量守恒,m不变,反应在恒容容器中进行,V不变,则整个过程混合气体密度
,反应前后质量守恒,m不变,反应在恒容容器中进行,V不变,则整个过程混合气体密度![]() 不变,无法判断化学反应是否达到化学平衡,故C错误;反应前后气体分子数改变,体系压强发生变化,可以通过压强判断化学反应是否达到平衡,故D正确;
不变,无法判断化学反应是否达到化学平衡,故C错误;反应前后气体分子数改变,体系压强发生变化,可以通过压强判断化学反应是否达到平衡,故D正确;
故答案为:D;
![]() 所求反应可由Ⅰ
所求反应可由Ⅰ![]() Ⅱ得到,根据多重平衡规则,所求反应的化学平衡常数为
Ⅱ得到,根据多重平衡规则,所求反应的化学平衡常数为![]() ;
;
故答案为:![]() ;
;
![]() 实验a中,起始时体系压强为320kPa,平衡时体系压强为240kPa,
实验a中,起始时体系压强为320kPa,平衡时体系压强为240kPa,
![]()
起始![]()
![]() 0
0
转化![]() x3x 2x
x3x 2x
平衡![]()
![]() 2x
2x
则有![]() ,可得
,可得![]() ,
,
所以实验a从开始至平衡时的反应速率![]() ,
,
实验c中![]() 的平衡转化率
的平衡转化率![]() 为
为![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,由此可判断实验b改变的条件是使用催化剂,
与实验a相比,实验b和实验a的平衡状态一致,实验b比实验a提前到达化学平衡,由此可判断实验b改变的条件是使用催化剂,
实验c的压强大于实验a的压强,由此可判断实验c改变的条件是增大压强;
故答案为:使用催化剂;增大压强;
![]() 实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,所以M点的逆反应速率
实验c的压强大于实验a的压强,增大压强有利于增大化学反应速率,所以M点的逆反应速率![]() 点的正反应速率
点的正反应速率![]() ;N点达到化学平衡状态,再加入一定量
;N点达到化学平衡状态,再加入一定量![]() ,促使化学平衡正向移动,则平衡后
,促使化学平衡正向移动,则平衡后![]() 的体积分数增大;
的体积分数增大;
故答案为:![]() ;增大。
;增大。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化。某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3。

(1)实验开始的步骤,组装好仪器,____________,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(2)C中的烧瓶发生如下反应:2Na2S+ Na2CO3+4SO2=3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是________;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因_________。
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是__________。
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是____________。
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取。为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
①实验1、2的目的是探究_________对亚硫酸钠转化率的影响;
②若要完成上表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行____次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为___________。