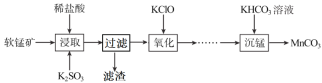
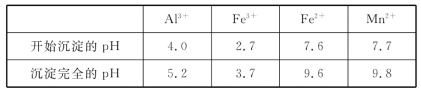
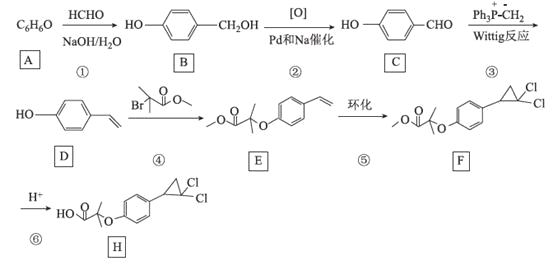
题目内容
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
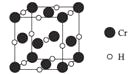
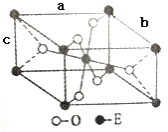
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
【答案】3d54s1 +6 > 2CrCl3+H2![]() 2CrCl3+2HCl 离子 sp2、sp3
2CrCl3+2HCl 离子 sp2、sp3 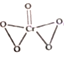 Cr4H4(或CrH)
Cr4H4(或CrH) ![]()
【解析】
(1)根据基态铬原子得核外电子排布,写出价电子排布式;根据价层电子,确定铬元素的最高价态;价电子处于半满或全满时比较稳定,电离能比较大;
(2)CrCl3在含HCl的H2气流中被还原,写出方程式;离子晶体的熔点较高;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
(3)CrO3中铬元素为+6价,则存在2个过氧根,确定结构式;
(4)均摊法确定化学式。确定一个晶胞的质量和体积,在计算晶胞密度;
(1)基态铬原子的价电子排布式为3d54s1;根据价层电子,铬元素的最高价态为+6。基态Cr+的价电子排布式为3d5、基态Mn+的加点字排布式为3d54s1,故铬元素的第二电离能大于锰元素的第二电离能;
答案:3d54s1 +6 >
(2)CrCl3在含HCl的H2气流中被还原,反应方程式为2CrCl3+H2![]() 2CrCl3+2HCl;CrCl3的熔点较高,为离子晶体;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
2CrCl3+2HCl;CrCl3的熔点较高,为离子晶体;CH3COO-中,甲基中的碳原子为sp3杂化,另一个碳原子为sp2杂化;
答案:2CrCl3+H2![]() 2CrCl3+2HCl 离子 sp2、sp3
2CrCl3+2HCl 离子 sp2、sp3
(3)CrO3中铬元素为+6价,则存在2个过氧根,结构式为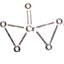 ;
;
答案:
(4)每个晶胞中的Cr原子数为8×1/8+6×1/2=4,H原子数为12×1/4+1=4,故其化学式为Cr4H4(也可以简化为CrH,但不可简化为Cr2H2)。一个晶胞的质量为![]() g,一个晶胞的体积为(4.376×10-8)3cm3,则晶体的密度为
g,一个晶胞的体积为(4.376×10-8)3cm3,则晶体的密度为![]() ;
;
答案:![]()

 阶梯计算系列答案
阶梯计算系列答案