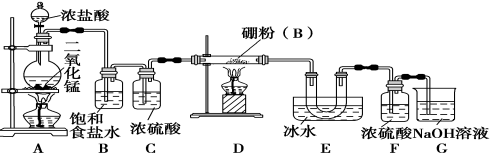
题目内容
【题目】下列有关热化学方程式的叙述正确的是
A.已知![]() ,则
,则![]() 的燃烧热为
的燃烧热为![]()
B.已知甲烷氧化:![]() ,则反应物的键能总和大于生成物的键能总和
,则反应物的键能总和大于生成物的键能总和
C.已知![]() ,则将
,则将![]() 和
和![]() 置于一密闭容器中充分反应后放出
置于一密闭容器中充分反应后放出![]() 的热量
的热量
D.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则该反应的热化学方程式为:
的热量,则该反应的热化学方程式为:![]()
【答案】D
【解析】
根据题中热化学方程式的叙述可知,本题考查热化学方程式的书写,运用书写热化学方程式的步骤和盖斯定律分析。
A.![]() 完全燃烧生成液态水时能量变化为燃烧热,由
完全燃烧生成液态水时能量变化为燃烧热,由![]() 反应可知,水不是液态,因此
反应可知,水不是液态,因此 ![]() 的燃烧热不是240.2KJ/mol,故A错误;
的燃烧热不是240.2KJ/mol,故A错误;
B.焓变为负,可知反应物的键能总和小于生成物的键能总和,故B错误;
C.合成氨为可逆反应,热化学方程式中为完全转化时的能量变化,且为放热反应,则将![]() 和
和![]() 置于一密闭容器中充分反应后放热小于
置于一密闭容器中充分反应后放热小于![]() ,故C错误;
,故C错误;
D.![]() ,与稀盐酸完全中和,放出
,与稀盐酸完全中和,放出 ![]() 的热量,可知
的热量,可知![]() ,故D正确。
,故D正确。
答案选D。

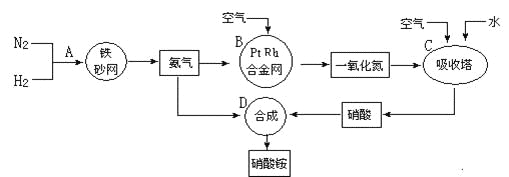
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
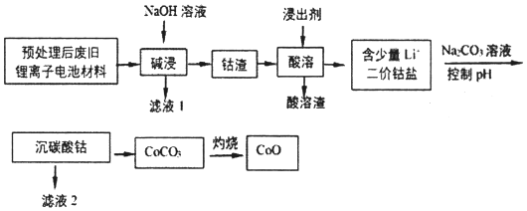
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L