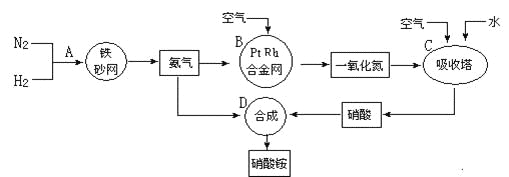
题目内容
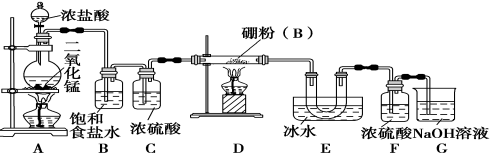
【题目】过碳酸钠![]() 是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:
是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:

已知:主反应![]()
![]()
![]()
![]()
副反应![]()
滴定反应:
![]() ,
,![]() 时
时![]() 开始分解。
开始分解。
请回答下列问题:
(1)图2中支管的作用是 ______ 。
(2)步骤![]() 的关键是控制温度,其措施有 ______ 和 ______ 。
的关键是控制温度,其措施有 ______ 和 ______ 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是 ______ 。
(4)步骤![]() 中选用无水乙醇洗涤产品的目的是 ______ 。
中选用无水乙醇洗涤产品的目的是 ______ 。
(5)下列物质中,加入到过碳酸钠溶液中,不会产生大量气体的是 ______ 。
A.MnO2 B.FeCl3 C.Na2SO3 D.NaOH E.HCl
(6)准确称取![]() 过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL
过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL![]()
![]() ,用
,用![]()
![]()
![]() 标准溶液滴定至终点时消耗
标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() 的质量分数为 ______ 。
的质量分数为 ______ 。
【答案】平衡压强 冷水浴,磁力搅拌 缓慢滴加![]() 溶液等 降低产品的溶解度
溶液等 降低产品的溶解度![]() 盐析作用或醇析作用
盐析作用或醇析作用![]() 洗去水份,利于干燥
洗去水份,利于干燥 ![]()
![]()
【解析】
过碳酸钠![]() 是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:
是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如图1:

已知:主反应![]()
![]()
![]()
![]()
副反应![]()
滴定反应:
![]() ,
,![]() 时
时![]() 开始分解。
开始分解。
请回答下列问题:
(1)图2中支管的作用是平衡压强,保证液体顺利滴下。
(2)步骤![]() 的关键是控制温度,由于反应放热,所以可以用冰水浴和磁力搅拌,还可以缓慢滴加双氧水。
的关键是控制温度,由于反应放热,所以可以用冰水浴和磁力搅拌,还可以缓慢滴加双氧水。
(3)从同离子效应以及相似相溶的角度考虑NaCl固体或无水乙醇使过碳酸钠析出的原因。
(4)用无水乙醇洗涤产品的目的是减少产品损失。
(5)可以把过碳酸钠的成分看做是碳酸钠和过氧化氢,判断和碳酸钠或过氧化氢能否反应以及反应是否产生气体做出选择。
(6)根据滴定方程式计算![]() 的质量分数。
的质量分数。
![]() 副反应化学方程式
副反应化学方程式![]() ,有气体生成导致压强增大,如不及时平衡压强,容易产生实验事故,所以支管有平衡压强的作用,保证液体顺利流出,故答案为:平衡压强;
,有气体生成导致压强增大,如不及时平衡压强,容易产生实验事故,所以支管有平衡压强的作用,保证液体顺利流出,故答案为:平衡压强;
![]() 反应温度较低,苯与硝酸反应的温度控制方法,即水浴法;搅拌也可以控制温度,所以还可用磁力搅拌的方法;让反应速率减小控制温度,所以可用缓慢滴加
反应温度较低,苯与硝酸反应的温度控制方法,即水浴法;搅拌也可以控制温度,所以还可用磁力搅拌的方法;让反应速率减小控制温度,所以可用缓慢滴加![]() 溶液的方法,故答案为:冷水浴;磁力搅拌;缓慢滴加
溶液的方法,故答案为:冷水浴;磁力搅拌;缓慢滴加![]() 溶液;
溶液;
![]() 加入氯化钠固体,钠离子浓度增大,降低了过碳酸钠的溶解度,可以析出过碳酸钠,加入有机物乙醇,过碳酸钠难溶于乙醇,降低了过碳酸钠的溶解度,可以析出过碳酸钠,
加入氯化钠固体,钠离子浓度增大,降低了过碳酸钠的溶解度,可以析出过碳酸钠,加入有机物乙醇,过碳酸钠难溶于乙醇,降低了过碳酸钠的溶解度,可以析出过碳酸钠,
故答案为:降低产品的溶解度![]() 盐析作用或醇析作用
盐析作用或醇析作用![]() ;
;
![]() 无水乙醇能和水互溶,且极易挥发,所以选用无水乙醇洗涤,所以其目的是:洗去水份,利于干燥,故答案为:洗去水份,利于干燥;
无水乙醇能和水互溶,且极易挥发,所以选用无水乙醇洗涤,所以其目的是:洗去水份,利于干燥,故答案为:洗去水份,利于干燥;
![]() 过碳酸钠可以看作
过碳酸钠可以看作![]() 和
和![]() 的混合物,
的混合物,![]() 、
、![]() 能作双氧水的催化剂,催化过氧化氢分解生成水和氧气,
能作双氧水的催化剂,催化过氧化氢分解生成水和氧气,![]() 有还原性,能被过碳酸钠氧化生成硫酸钠和水,无气体放出,氯化氢能和碳酸钠反应生成氯化钠和水和二氧化碳,只有氢氧化钠不反应,所以加入到过碳酸钠溶液中,不会产生大量气体的是亚硫酸钠和氢氧化钠,故答案为:CD;
有还原性,能被过碳酸钠氧化生成硫酸钠和水,无气体放出,氯化氢能和碳酸钠反应生成氯化钠和水和二氧化碳,只有氢氧化钠不反应,所以加入到过碳酸钠溶液中,不会产生大量气体的是亚硫酸钠和氢氧化钠,故答案为:CD;
![]() 由高锰酸钾和过氧化氢反应的关系式可知
由高锰酸钾和过氧化氢反应的关系式可知![]()
![]()
![]()
过氧化氢的质量为:![]()
过氧化氢的质量分数![]()
故答案为:![]() .
.

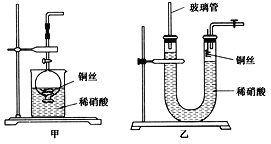
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化。某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3。

(1)实验开始的步骤,组装好仪器,____________,按图示加入试剂,关闭K1打开K2,先向C中烧瓶加入Na2S和 Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(2)C中的烧瓶发生如下反应:2Na2S+ Na2CO3+4SO2=3Na2S2O3+CO2,反应开始后,C中先有浑浊产生,后又变澄清,此浑浊物是________;为了保证Na2S2O3的产量,实验中通入C的SO2不能过量,用离子方程式表示其原因_________。
(3)该实验制得的产品中含有NaSO4杂质,为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验开始的步骤进行了改进,改进后的操作是__________。
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,具体操作方法是____________。
(5)制取Na2S2O3的另一种方法是直接将硫粉和亚硫酸钠,数混合共热制取。为探究制取硫代硫酸钠最佳条件,设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
①实验1、2的目的是探究_________对亚硫酸钠转化率的影响;
②若要完成上表中列出的各项条件对亚硫酸钠转化率的影响探究,除实验1、2外,至少还需进行____次对比实验;
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.原因为___________。