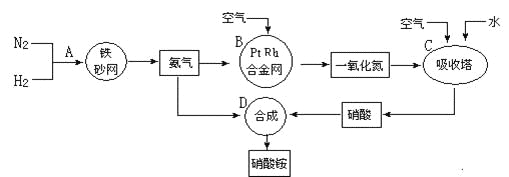
��Ŀ����
����Ŀ�������������壨[CH3CH��OH��COO]2Fe3H2O��Mr=288���dz��õIJ�������������������������FeCO3��Ӧ�Ƶá�
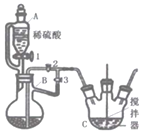
���Ʊ�̼��������FeCO3��
��1������B��������______��
��2��������ͼ��ʾװ�ý���ʵ�飬������������������
��һ��������1��3���رջ���2����Ӧһ��ʱ�䣻
�ڶ������رջ���3������2������C���а�ɫ�������������ɡ�
�ٵ�-�����Ŀ���ǣ�______��
��C�з�Ӧ���ɰ�ɫ���������ӷ���ʽ�ǣ�______��
������C�еĻ���ᆳ���ˣ�ϴ�Ӻ�õ�FeCO3�������������Ƿ�ϴ���ķ�����______�������������ͽ��ۣ���
�ܴӲ�Ʒ���ȽǶ�ָ����ʵ��װ���д��ڵ�ȱ��______��
���Ʊ�������������Ͷ�������
��1���Ʊ������������塣���Ƶõ�FeCO3���뵽������Һ�У������������ۣ���70���½���ʹ��Ӧ��ֽ��У�һ��ʱ����������ᴿ��������������Һ�еõ������������塣�����ʵ�����Ʒ���Ʊ������Ƿ����������������ʣ������������ͽ��ۣ���______��
��2���õ������ⶨ������Ʒ����Ԫ�صĺ�����������Ʒ�Ĵ��ȡ���ȡ3.00g������Ʒ�����������������ճɻң�������ϡ�����ܽ⣬�����п��������l00mL��Һ��ȡ25.00mL����Һ���������KI��Ӧ�����뼸��______��ָʾ������0.10mol/L�������������Һ�ζ���I2+2S2O32-=S4O62-+2I-�����ظ�ʵ��3�Σ��ζ��յ�ʱƽ���������������25.00mL������Ʒ����Ϊ______��
���𰸡�������ƿ �������ɵ������ž�װ���ڵĿ�������ֹ������������ Fe2++2HCO3-=FeCO3��+CO2��+H2O ȡ���һ��ˮϴҺ���Թ��У��������ϡ�����ữ���μ�һ������BaCl2��Һ�����ް�ɫ���dz��֣���ϴ�Ӹɾ� ʵ��װ�����Ӧ��Һ�⣬��ֹ��������������C��������Ʒʹ�䴿�Ƚ��� ��ϸ����ˮ�ܽ⣬����KSCN��Һ������Һ�����ɫ��˵��δ������ ���� 96%
��������
��.�Ʊ�̼������(FeCO3)�������������ױ������������Ʊ�������Ӧ�����������н��У�Fe��ϡ���ᷴӦ�Ʊ��������������÷�Ӧ���ɵ������ž�װ���еĿ�������B�Ʊ�����������Cװ��������������NH4HCO3������Ӧ��Fe2+ + 2HCO3��=FeCO3��+CO2��+H2O����������������ʹBװ������ѹ����Bװ���е��Ȼ�������Һѹ��C�С�
�Ÿ�������ͼ���жϡ�
�Ƣٹرջ���2������1��3����ʹ���ɵ������ų�װ���ڵĿ������ڹرջ���3������2���ɽ����ɵ�����������Һ�ŵ�װ��C�У�������Ӧ����̼��������ͬʱ���ɶ�����̼���ۼ���ϴ��FeCO3���������һ��ϴ��Һ���Ƿ����SO42-���жϳ����Ƿ�ϴ�Ӹɾ�����Fe2+�н�ǿ��ԭ�ԣ��ױ�������������������ȡ̼���������������Ӧ��С�����������ĸ��š�
��Fe3+����KSCN��Һ��Ӧ����������������Һ��Ѫ��ɫ��
��I2�ĵ�����Һ����ɫ���μ������������Һ����ɫ���dz��������ɫ����֪2Fe3++2I��= I2 + 2Fe2+��I2+2S2O32�� = S4O62��+2I�����ù�ϵʽ2Fe3+��I2��2S2O32�������ݵζ�ʱ�μӷ�Ӧ����������Ƶ����ʵ��������Fe2+�����ʵ������ټ�����Ʒ���ȡ�
��.��������ͼ�ο�֪BΪ������ƿ;�ʴ�Ϊ��������ƿ��
�Ƣٹرջ���2������1��3����ʹ���ɵ������ų�װ���ڵĿ������ž�װ���ڵĿ�������ֹ���������������ʴ�Ϊ���������ɵ������ž�װ���ڵĿ�������ֹ��������������
�ڹرջ���3������2���ɽ����ɵ�����������Һ�ŵ�װ��C�У�������Ӧ����̼��������ͬʱ���ɶ�����̼����Ӧ�����ӷ���ʽΪFe2++2HCO3-=FeCO3��+CO2��+H2O���ʴ�Ϊ��Fe2++2HCO3-=FeCO3��+CO2��+H2O��
��ȡ���һ��ˮϴҺ���Թ��У��������ϡ�����ữ���μ�һ������BaCl2��Һ�����ް�ɫ���dz��֣������ϴ��Һ�в�����SO42-�������ж�FeCO3����ϴ�Ӹɾ����ʴ�Ϊ��ȡ���һ��ˮϴҺ���Թ��У��������ϡ�����ữ���μ�һ������BaCl2��Һ�����ް�ɫ���dz��֣���ϴ�Ӹɾ���
��Fe2+�н�ǿ��ԭ�ԣ��ױ�������������������Ӧ������������ֹ���������ʴ�Ϊ��ʵ��װ�����Ӧ��Һ�⣬��ֹ��������������C��������Ʒʹ�䴿�Ƚ��͡�
��Fe3+����KSCN��Һ��Ӧ����������������Һ��Ѫ��ɫ�����Կ�����KSCN��Һ���������ӣ�����鷽��Ϊ��ϸ���������ܽ⣬����KSCN��Һ������Һ���ɫ��˵���ѱ��������ʴ�Ϊ����ϸ����ˮ�ܽ⣬����KSCN��Һ������Һ�����ɫ��˵��δ��������
��I2�ĵ�����Һ����ɫ���μ������������Һ����ɫ���dz������ɫ�պ���ȥ�Ұ���Ӳ��ָ��������ж�Ϊ�ζ��յ㣻���ݹ�ϵʽ2Fe3+��I2��2S2O32����������Ʒ����Ϊ��
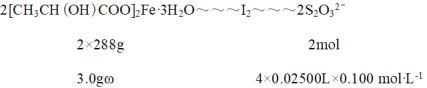
![]() �����
�����![]() ���ʴ�Ϊ�����ۣ�96%��
���ʴ�Ϊ�����ۣ�96%��

����Ŀ��2019��ŵ������ѧ�������ڿ�������ӵ�ط�������Խ������λ��ѧ�ҡ����ô�����ķϾ�����ӵ�ز��ϣ���Ҫ�ɷ�ΪCo3O4������������������LiCoO2�����ʣ��Ʊ�CoO������������ͼ��
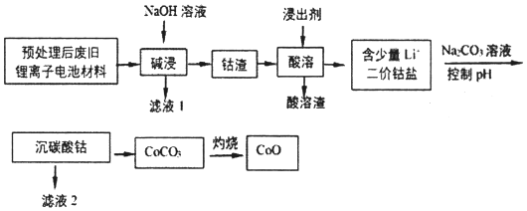
�ش��������⣺
��1��CoԪ����Ԫ�����ڱ��е�λ��___��
��2���Ͼ�����ӵ�ز��ǰ�������ŵ紦��������������������յ�ԭ����___������������Ч�ʵĴ�ʩ��____������д���֣���
��3����ͬ����������������������
���� | ����Һ��ѧ�ɷ�/��gL-1�� | �ܽ�����/% | |
Co | Al | ||
��a��HCl | 80.84 | 5.68 | 98.4 |
��b��H2SO4 | 65.0 | 6.22 | 72.3 |
��c��H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
�ٽ�������a�����ܽ�������ߣ���ʵ�ʹ�����һ�㲻ѡ�ý�������a����ԭ����____��
���¶�Խ�߽�����Ӧ����Խ�죬������������һ��ѡ�ýϸߵ��¶ȡ��ݴ���ѡ��Ľ�������___������ţ���������___��
�۴�������ԭ�Ƕȷ�������ԭ�����ʵ�����Co3O4����Ҫ___������H2O2������Na2S2O3�������ʵ������١�
�����Ϸ�����д������ʵĽ�������Co3O4��Ӧ�Ļ�ѧ����ʽ____��
��4����֪��Ksp[Co��OH��2]=1.0��10-15��Ksp��Li2CO3��=1.7��10-3��Ksp��CoCO3��=1.5��10-13������Һ2��Co2+����Ϊ5.9��10-2gL1�������ж�����̼������Ӧ����pH������____��
����Ŀ������ͼʾʵ��װ�ÿ���ɶ���ʵ��,���в��ܴﵽ��Ӧʵ��Ŀ�ĵ���

ѡ�� | �Լ�1���Լ�2 | ʵ��Ŀ�� |
A | ����п����ʳ����Һ | �ⶨʳ���д���Ũ�� |
B | ��п������ϡ���� | �ⶨ��п�����в����뷴Ӧ�����ʣ����� |
C | ̼���ƹ��塢ˮ | ֤��̼����ˮ������ |
D | �������ƹ��塢ˮ | ֤������������ˮ��Ӧ�������� |
A.AB.BC.CD.D