题目内容
1.下列溶液,阴离子总浓度最大的是( )| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
分析 阴离子浓度为溶质的浓度×阴离子个数,结合物质的构成、盐类水解来计算.
解答 解:A.硝酸根离子的浓度为0.2mol/L;
B.氯离子的浓度为0.1mol/L×2=0.2mol/L;
C.不考虑水解时碳酸根离子的浓度为0.2mol/L,且CO32-+H2O?HCO3-+OH-,阴离子增多,则阴离子浓度大于0.2mol/L;
D.硫酸根离子的浓度为0.2mol/L,
故选C.
点评 本题考查离子浓度的计算,为高频考点,把握物质的构成、盐类水解为解答的关键,侧重分析与计算能力的考查,注意水解反应的判断,题目难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
11.N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质.下列说法正确的是( )
| A. | 2N5 →5N2是化学变化 | B. | N5和N2互为同位素 | ||
| C. | 原子半径:r(N)<r(O) | D. | 18O2中含18个中子 |
12.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
16.室温下,在某NaHSO4溶液中离子的总浓度为0.6mol/L,若向其中加入等体积离子总浓度为0.6mol/L的Ba(OH)2,下列说法不正确的是( )
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
6.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为1:5:2:1共同存在于同一种溶液中,那么M离子可能是( )
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
19.不能鉴别乙醇溶液和乙酸溶液的试剂是( )
| A. | 氢氧化铜 | B. | 碳酸氢钠 | C. | 石蕊溶液 | D. | 金属钠 |
20.如图分别表示冰晶体、干冰晶体、金刚石晶体结构,关于这些晶体的说法正确的是( )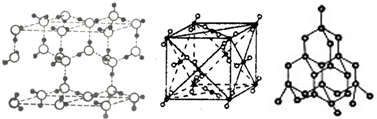

| A. | 冰晶体中只存在分子间作用力和氢键 | |
| B. | 沸点:金刚石>干冰>冰 | |
| C. | 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构 | |
| D. | 干冰晶体中每个CO2周围等距离且最近的CO2有10 个 |
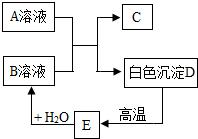 A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:
A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答: