题目内容
2.合成氨N2(g)+3H2(g)?2NH3(g)是人类科技史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题.(1)合成氨的原料气H2可由CH4和H2O(g)在高温下反应获得(同时产生CO).已知CH4、CO、H2的燃烧热分别为890.3kJ•mol-1、283.0kJ•mol-1、285.8kJ•mol-1,H2O的汽化热为44kJ•mol-1.写出由CH4制取H2的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,合成氨在恒压密闭容器中达到平衡的标志有ce(填序号)
a.3v正(H2)=2v逆(NH3) b用NH3、N2、H2表示反应速率比为2:1:3
c.混合气体的密度不再改变 d.混合气体压强不再改变
e.混合气体平均相对分子质量不再改变 f.容器内N2、H2、NH3的浓度之比为1:3:2
(3)某实验室模拟工业合成氨,在三个不同条件下的密闭容器中分别加入N2和H2,起始浓度均为c(N2)=0.1mol/L,c(H2)=0.2mol/L,反应过程中c(N2)随时间的变化如图1中曲线I、Ⅱ、Ⅲ所示

①该反应在实验I中,从开始达到平衡时N2的平均反应速率为0.002mol/(L•min),其化学平衡常数K的值为208.3.(保留一位小数)若在恒温恒压条件下,向容器中通人氦气,平衡将不移动 (填“向左移动”“向右移动”“不移动”);此时,平衡常数的值将不变(填“变大”“变小”“不变”)
②已知Ⅱ、Ⅲ装置中各有一个条件与I不同,据图所示推测Ⅱ、Ⅲ不同于①的条件分别是加入催化剂;升高温度
(4)实验室研究在一定温度和压强下合成氨反应中H2和N2起始物质的量之比[n(H2)/n(N2)]对合成氨的影响.在恒温下1L容器中,将总物质的量一定的H2和N2以不同的氢氮比进行反应,实验测得平衡体系中氨气体积分数的变化如图2所示.回答下列问题:
M点对应的横坐标为3,达到平衡时,已知N2的体积分数为15.6%,则M点对应的纵坐标为37.6.
分析 (1)依据燃烧热的热化学方程式结合盖斯定律计算,写出热化学方程式;
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;
(3)①由图可知,20min时到达平衡,氮气的浓度变化量为(1-0.06)mol/L=0.04mol/L,再根据v=$\frac{△C}{△t}$计算v(N2);运用化学平衡常数计算表达式计算化学平衡常数;通入氦气无法引起各组分浓度的变化进而无法影响平衡移动,化学平衡常数只受温度的影响温度不变平衡常数不变;
②与实验Ⅰ相比,实验Ⅱ反应速率加快,平衡氮气浓度不变,不能是增大压强或升高温度,可能是加入催化剂;而实验Ⅲ反应速率减慢,平衡时氮气的浓度增大,正反应为体积减小的放热反应,不能是减小压强,可能是降低升高温度;
(4)当N2和H2的物质的量之比为1:3时平衡时氨气的百分含量最大,据此可以推算出M点的纵坐标的数值.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)a.3v正(H2)=2v逆(NH3)说明正逆反应速率不相等,说明反应未达到平衡状态,故a错误;
b.不论该可逆反应是否达到化学平衡状态,用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比一定为1:3:2,无法判断是否达到化学平衡状态,故b错误;
c.该容器的压强保持不变,根据质量守恒定律知,反应前后混合气体的质量不变,所以容器内气体的密度变化,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故c正确;
d.合成氨在恒压密闭容器中进行,压强始终不变,所以不能表达该反应已经达到平衡状态,故d错误;
e.混合气体平均相对分子质量=$\frac{总质量}{总物质的量}$,反应前后质量不变,若平均相对分子质量不变则气体总物质的量可以说明反应已经达到平衡状态,故e正确;
f.浓度之比不能判断各组分的浓度是否变化,正逆反应速率是否相等,无法判断是否达到了平衡状态,故f错误;
故选ce;
(3))①由图可知,20min时到达平衡,氮气的浓度变化量为(1-0.06)mol/L=0.04mol/L,则v(N2)=$\frac{0.04mol/l}{20min}$=0.002mol/(L•min),故答案为:0.002mol/(L•min);化学平衡常数K=$\frac{{c}^{2}(NH3)}{c(N2){c}^{3}(H2)}$=$\frac{{0.08}^{2}}{{0.06×0.08}^{3}}$208.3,故答案为208.3;
②与实验Ⅰ相比,实验Ⅱ反应速率加快,平衡氮气浓度不变,不能是增大压强或升高温度,可能是加入催化剂;而实验Ⅲ反应速率减慢,平衡时氮气的浓度增大,正反应为体积减小的放热反应,不能是减小压强,升高温度反应速率加快,平衡逆向移动,可能是升高温度,
故答案为:加入催化剂;升高温度;
(4)当N2和H2的物质的量之比为1:3时平衡时氨气的百分含量最大,所以横坐标数值为3;
N2+3 H2=2NH3
起始:a 3a
△:b 3b 2b
平衡:a-b 3a-3b 2b
已知平衡时N2的体积分数为15.6%,则H2的体积分数为N2的3倍为46.8%,可以推得NH3的分数为1-15.6%-46.8%=37.6%,故答案为:3;37.6.
点评 本题考查了燃烧热概念和热化学方程式的书写,化学反应速率和平衡常数的计算,化学平衡状态的判断,整体有一定的难度.

| A. | 煤的干馏、石油分馏、石油裂解都是化学反应 | |
| B. | 煤经过气化、液化等化学变化可得到清洁燃料 | |
| C. | 人造纤维、合成纤维和油脂都是有机高分子化合物 | |
| D. | 棉花、羊毛、蚕丝、麻都由C、H、O元素构成 |
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
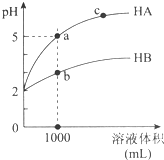 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
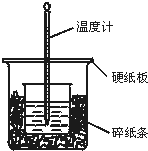 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: