题目内容
20.如图分别表示冰晶体、干冰晶体、金刚石晶体结构,关于这些晶体的说法正确的是( )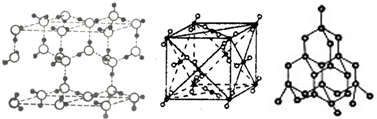
| A. | 冰晶体中只存在分子间作用力和氢键 | |
| B. | 沸点:金刚石>干冰>冰 | |
| C. | 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构 | |
| D. | 干冰晶体中每个CO2周围等距离且最近的CO2有10 个 |
分析 A.冰分子内存在共价键;
B.冰存在氢键,沸点比干冰高;
C.冰晶体中的氧原子和金刚石中的碳原子都为sp3杂化;
D.二氧化碳位于晶胞的定点,与之距离最近的二氧化碳分子位于面心.
解答 解:A.冰为水的固体,水分子内存在共价键,故A错误;
B.冰存在氢键,沸点比干冰高,故B错误;
C.冰晶体中的氧原子和金刚石中的碳原子都为sp3杂化,则可形成四面体结构,故C正确;
D.二氧化碳位于晶胞的定点,与之距离最近的二氧化碳分子位于面心,共有3×8×$\frac{1}{2}$=12.故D错误.
故选C.
点评 本题综合考查晶体的结构和性质,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握晶体的类型和作用力,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列溶液,阴离子总浓度最大的是( )
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
11.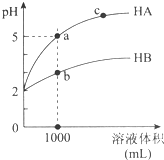 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
8.下列原子的外围电子排布式正确的是( )
| A. | S:3p4 | B. | Cr:3d44s2 | C. | Se:5s25p6 | D. | Cu:3d104s1 |
15.某强酸性溶液X可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
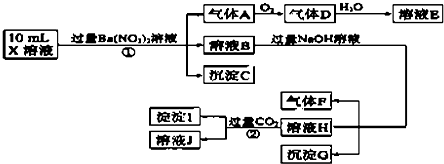
测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )

测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
5.下列说法不正确的是( )
| A. | 氢能、核能均是无污染的高效能源 | |
| B. | 公共汽车大部分采用天然气作为燃料可减少对大气的污染 | |
| C. | 把煤转化为液态燃料可提高煤的燃烧效率 | |
| D. | 使用催化剂,能增大活化分子百分数,所以反应速率增大 |
9.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
10.下列离子方程式书写正确的是( )
| A. | 金属铁与稀硝酸反应:Fe+2H+→Fe2++H2↑ | |
| B. | 金属铝与烧碱溶液的反应:Al+2OH-→AlO2-+H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 偏铝酸钠溶液中加过量盐酸:AlO2-+4H+=Al3++2H2O |