题目内容
13. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题(1)乙酸乙酯的实验制法常采用如下反应:
CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
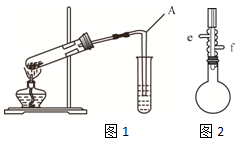
图1为课本上制取乙酸乙酯的实验装置图,
①本实验中加入过量乙醇的目的是提高乙酸的转化率.
②导管A的下端不能伸入溶液中的原因是防止倒吸;用饱和Na2CO3溶液而不用NaOH溶液来接收乙酸乙酯的原因是乙酸乙酯与NaOH发生水解反应.
③反应结束后从所得混合液中分离出乙酸乙酯所用的仪器是分液漏斗.
④为了提高实验的冷凝效果,可改用下列b装置(填编号)制备乙酸乙酯,收集产品时应控制温度在77.5℃左右
(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(图中略去了加热装置和橡胶导管等仪器):
①写出苯甲酸和甲醇反应制取甲苯酸甲酯的化学方程式
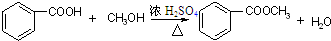 .
.②此装置中冷凝管的作用是,水流应从f口进入冷凝管(填“e”或“f”).
分析 (1)①乙醇过量,可促进乙酸的转化;
②乙酸、乙醇易溶于水,要防止倒吸,乙酸乙酯与NaOH发生水解反应;
③反应结束后,乙酸乙酯与碳酸钠溶液分层,且碳酸钠溶液在下层;
④长导管冷凝回流效果好,冷凝管中冷却水下进上出,乙酸乙酯的沸点为77.5℃;
(2)①类比乙酸和乙醇的反应原理;
②冷凝管中冷却水下进上出.
解答 解:(1)①本实验中加入过量乙醇的目的是提高乙酸的转化率,故答案为:提高乙酸的转化率;
②乙酸、乙醇易溶于水,导管A的下端不能伸入溶液中的原因是防止倒吸,乙酸乙酯与NaOH发生水解反应,不能用NaOH溶液来接收乙酸乙酯,
故答案为:防止倒吸;乙酸乙酯与NaOH发生水解反应;
③反应结束后,乙酸乙酯与碳酸钠溶液分层,且碳酸钠溶液在下层,分液可分离,则反应结束后从所得混合液中分离出乙酸乙酯所用的仪器是分液漏斗,
故答案为:分液漏斗;
④长导管冷凝回流效果好,冷凝管中冷却水下进上出,则选b装置,乙酸乙酯的沸点为77.5℃,则控制温度为77.5℃,
故答案为:b;77.5;
(2)①制备苯甲酸甲酯的反应方程式为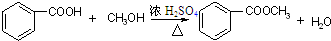 ;
;
故答案为: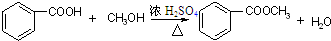 ;
;
②冷凝器采用逆向通水效果好,故从f通水,故答案为:f.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、混合物分离为解答的关键,侧重分析与应用能力的考查,注意实验装置的应用,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 苯中含有三个碳碳双键 | |
| B. | 乙酸中的官能团是羟基 | |
| C. | 乙醇不能与金属钠反应 | |
| D. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 |
1. 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A. | 合成乙醇的反应一定为吸热反应 | |
| B. | 目前工业上采用250~300℃,主要是因为在此温度下乙烯的转化率最大 | |
| C. | 目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 | |
| D. | 只要给予该反应足够的压强,就可以实现转化率100% |
8.2,3,4三甲基戊烷与氯气发生取代反应时,生成的一氯化物有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.下列叙述正确的是( )
| A. | 食盐水克导电,所以食盐水是电解质 | |
| B. | NH3的水溶液能够导电,所以NH3电解质 | |
| C. | 蔗糖溶于水不导电,所以蔗糖是非电解质 | |
| D. | BaSO4投入水中,导电性极弱,所以BaSO4是弱电解质 |
5.面粉厂必须严禁烟火的主要原因是( )
| A. | 防止火灾发生 | B. | 防止污染面粉 | C. | 吸烟有害健康 | D. | 防止面粉爆炸 |
2.在FeCl2、CuCl2和FeCl3的混合溶液中加入铁粉,充分反应后,滤出的不溶物中除铜酸外,还有少量铁粉,则滤液中( )
| A. | 肯定有Fe3+,一定没有Cu2- | B. | 肯定有Fe3+,一定没有Fe2+和Cu2- | ||
| C. | 肯定有Cu2-,一定没有Fe3+ | D. | 肯定有Fe2+,一定没有Fe3+和Cu2+ |
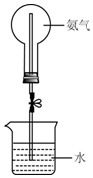 某学习小组研究氨气的喷泉实验.
某学习小组研究氨气的喷泉实验.