题目内容
3.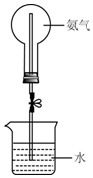 某学习小组研究氨气的喷泉实验.
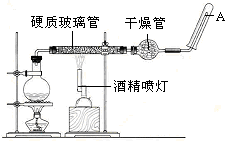
某学习小组研究氨气的喷泉实验.(1)如果提供如图所示装置,说明引发喷泉的方法:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气而与水接触,即产生喷泉
(2)在标准状况下,在三个干燥的烧瓶内分别装有:干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体(体积比为4:1).然后分别作喷泉实验,三个烧瓶中所得的溶液的物质的量浓度之比为C.
A.2:1:2
B.1:1:1
C.5:5:4
D.无法确定.
分析 (1)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时会导致烧瓶内压强减小;
(2)根据相同条件下,体积之比等于物质的量之比,判断氨气、氯化氢、二氧化氮的物质的量关系;
氨气溶于水,溶液体积等于氨气体积,含一半空气的氯化氢,氯化氢溶于水,溶液体积大于HCl的体积,二氧化氮和氧气(体积比为4:1)溶于水发生反应4NO2+O2+2H2O═4HNO3,溶液体积等于混合气体的体积,再根据c=$\frac{n}{V}$判断.
解答 解:(1)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时,因氨气极易溶于水而导致烧瓶内压强迅速减小而形成喷泉,引发喷泉的方法:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气而与水接触,即产生喷泉,
故答案为:打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气而与水接触,即产生喷泉;
(2)在相同条件下,气体摩尔体积相同,烧瓶的容积相同,根据n=$\frac{V}{Vm}$知,氨气、氯化氢、NO2、O2的物质的量之比为1:$\frac{1}{2}$:$\frac{4}{5}$;做喷泉实验时,盛放氨气的烧瓶、含一半空气的氯化氢气体的烧瓶、含NO2和O2的混合气体(体积比为4:1)的烧瓶,各烧瓶中溶液的体积分别为:V、$\frac{1}{2}$V、V,所以溶液的体积比为2:1:2,则其物质的量浓度之比为:$\frac{1}{V}$:$\frac{\frac{1}{2}}{\frac{1}{2}V}$:$\frac{\frac{4}{5}}{V}$=5:5:4;
故选:C.
点评 本题考查喷泉实验、物质的量浓度的计算,题目难度中等,明确喷泉实验的原理、把握二氧化氮与水反应的性质,然后根据物质的量浓度的计算公式进行计算,题目难度中等.

| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | Fe(OH)3胶体中的HCl(过滤) | D. | SiO2和CaCl2(溶解、过滤、蒸发) |
| A. | 使石蕊变红色的溶液:Fe2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Mg2+、Cl-、Al3+ | |
| C. | 0.1mol•L-1Na2SO3溶液:K+、SO42-、ClO- | |
| D. | 0.1mol•L-1NaAlO2溶液:Na+、Cl-、OH-、SO42- |
| 阴离子 | SO42-、NO3-、CO32-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变.
③若向原溶液中加入BaCl2溶液,有白色沉淀生成.
④若向原溶液中加入足量NaOH溶液至阳离子恰好沉淀完全,充分反应后静置一段时间,过滤、洗涤、烧灼、最终所得固体的质量为ag.下列说法正确的是( )
| A. | 若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验现象为有血红色沉淀生成 | |
| B. | 原溶液中含有的阳离子为Fe2+、Al3+ | |
| C. | 用排水法可收集所产生的气体体积为$\frac{22.4}{3}$L | |
| D. | a=160 |
| A. | 铁、纯碱、冰水混合物 | B. | 氢气、陶瓷、漂白粉 | ||
| C. | 液氧、烧碱、碘酒 | D. | 金刚石、二氧化碳、漂粉精 |
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3、CO32-、SO42-、SiO32- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是Ag+、Mg2+、Ba2+.
(2)实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(4)判断K+是否存在存在,(填“是”或“否”)若存在求其最小浓度,若不存在说明理由其浓度至少为0.8mol/L.
| 序号 | 甲 | 乙 | 丙 |
| ① | HCl | CO2 | 少量NaAl(OH)4 |
| ② | CO2 | NH3 | 少量CaCl2 |
| ③ | N2 | NH3 | 少量AgNO3 |
| ④ | CO2 | SO2 | 过量Ba(NO3)2 |
| ⑤ | HCl | CO2 | 过量石灰水 |
| A. | ②③④ | B. | ②④ | C. | ①③ | D. | ④⑤ |
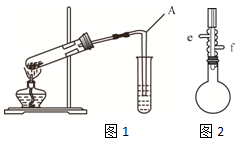 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
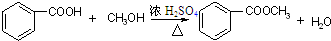 .
.