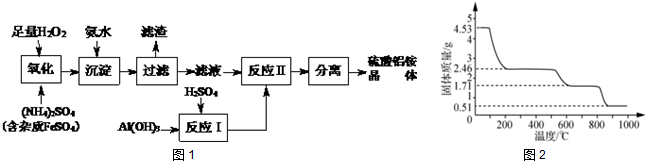
题目内容
6.已知丙烷的燃烧热△H=-2215kJ•mol-1,若一定量的丙烷完全燃烧后生成1.8g液态水,则放出的热量约为( )| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
分析 根据丙烷的燃烧热△H=-2215kJ•mol-1写出热化学方程式,然后根据生成水的质量计算放出的热量.
解答 解:丙烷的燃烧热△H=-2215kJ•mol-1,则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215kJ•mol-1,一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为$\frac{2215×1.8}{4×18}$kJ=55.375kJ≈55kJ,
故选:A.
点评 本题考查了燃烧热的概念、反应热的计算,题目难度不大,注意把握燃烧热的概念即1mol纯物质完全燃烧生成稳定氧化物放出的热量.

练习册系列答案
相关题目
16.800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
18.在无色透明酸性溶液中,能共存的离子组是( )
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、OH-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
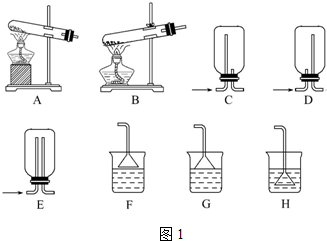
15.如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( )

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
16.已知 25℃时有关弱酸的电离平衡常数如下:
下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |