题目内容
19.已知复分解反应:2CH3COOH+Na2CO3═2CH3COONa+H2O+CO2↑可自发进行.在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH值 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| A. | CO2+H2O+NaClO═NaHCO3+HClO | B. | CO2+H2O+2NaClO═Na2CO3+2HClO | ||
| C. | CH3COOH+NaCN═CH3COONa+HCN | D. | CH3COOH+NaClO═CH3COONa+HClO |
分析 5种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行.
解答 解:A.碳酸酸性大于次氯酸,反应CO2+H2O+NaClO═NaHCO3+HClO能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应CO2+H2O+2NaClO═Na2CO3+2HClO不能发生,故B错误;
C.CH3COOH酸性大于HCN,反应CH3COOH+NaCN═CH3COONa+HCN能发生,故C正确;
D.醋酸酸性大于次氯酸,反应CH3COOH+NaClO═CH3COONa+HClO能发生,故D正确.
故选B.
点评 本题考查了酸性强弱与电离平衡常数的关系及难溶物溶度积的计算,题目难度中等,明确酸性强弱与电离平衡常数的关系为解答关键,注意掌握难溶物溶度积的表达式及计算方法,试题培养了学生的灵活应用能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
7.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列各组物质熔化时所克服的微粒间的作用力与氮化硼熔化时所克服的微粒间的作用力都相同的是( )
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
4.检验二氧化硫气体中是否混有二氧化碳气体,可采用的方法是( )
| A. | 通过品红溶液 | |
| B. | 先通过氢氧化钠溶液,再通过澄清石灰水 | |
| C. | 先通过饱和碳酸氢钠溶液,再通过澄清石灰水 | |
| D. | 先通过酸性高锰酸钾溶液,再通过澄清石灰水 |
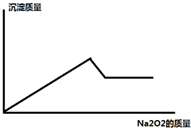 某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
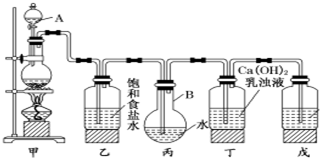
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液. 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题: .
.