题目内容
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+) | |
| B. | 元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高 | |
| C. | 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 | |
| D. | 化合物X2Z2与W2Z2所含化学键类型完全相同 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.Y是空气中含量最高的元素,则Y为N元素;Z原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Z2-与W+具有相同的电子层结构,则W为Na;X与W同主族,X、W的单质在标准状况下的状态不同,则X为H元素.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大.Y是空气中含量最高的元素,则Y为N元素;Z原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Z2-与W+具有相同的电子层结构,则W为Na;X与W同主族,X、W的单质在标准状况下的状态不同,则X为H元素.
A.离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+),同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中氢原子半径最小,故原子半径:r(Na)>r(N)>r(O)>r(H),故A错误;
B.非金属性N<O,故氧元素氢化物稳定性更强,常温下水为液体,而氨气为气体,水的熔沸点较高,故B错误;
C.由X、Y、Z三种元素形成的化合物可能为硝酸、硝酸铵、一水合氨等,一水合氨的水溶液呈碱性,故C正确;
D.化合物H2O2只含有共价键,而Na2O2含有共价键、离子键,故D错误.
故选:C.
点评 本题考查原子结构和元素周期律,关键是推断元素,侧重对元素周期律与元素化合物知识的考查,题目难度中等.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
12.向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a≤b时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2═CO32-+HCO3-+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
19.等物质的量浓度的下列溶液中,c(H+)最大的是( )
| A. | NaHSO4 | B. | NaHCO3 | C. | NaH2PO4 | D. | CH3COOH |
3.下列叙述中正确的是( )
| A. | 离子化合物中一定不含非极性共价键 | |
| B. | 原子晶体的熔点一定高于其他晶体 | |
| C. | 金属晶体的堆积方式的空间利用率最低的是Po | |
| D. | 构成晶体的粒子一定含有化学键 |
20.现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
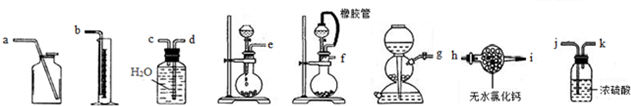
(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
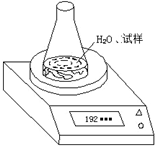
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:
①不必作第六次读数的原因是第4、5次试验读数相同,表明锥形瓶内质量已达恒定反应进行完全.
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.

(1)第一种方案:请从图中选用适当的装置,设计一个实验,测定CaC2试样的纯度.所选装置的连接顺序为(按气流方向,用接口字母表示):fcdb.若实验时称取的试样为 m g,产生的乙炔在标准状况下的体积为n mL,此试样中CaC2的质量分数为$\frac{64n}{22400m}$×100%.
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样6.80g、锥形瓶和水的质量为188.00g,再将试样加入锥形瓶中,用电子天平称量,实验装置如图所示.反应过程中每隔相同时间测得的数据如表:

| 锥形瓶+水+试样 | |||||
| 读数次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 质量/g | 192.80 | 192.30 | 192.10 | 192.00 | 192.00 |
②有同学认为用此装置测得的数据比真实值小,试分析原因:水蒸气随C2H2挥发.
③如何在原有装置上进行改进,使结果更加准确.请简要描述你的方案:在锥形瓶口添加一个带有无水氯化钙的干燥管的单孔橡皮塞.
(3)第三种方案:称取6.80g试样,用200mL 1.85mol/L的稀盐酸溶解,将所得的溶液转移至500mL容量瓶中,定容.取20mL定容后的溶液,用0.20mol/L的NaOH溶液滴定至终点,消耗NaOH溶液30.00mL,则6.80g试样中CaC2的质量为5.12g.