题目内容
11.O2和O3是氧元素的两种单质,等质量的O2和O3所含分子个数比为3:2,原子数目之比为1:1.分析 假设O2和O3的质量均为48g,根据n=$\frac{m}{M}$计算各自物质的量,分子数目之比等于其物质的量之比,均由O原子构成,则氧原子质量相等,含有O原子数目相等.
解答 解:假设O2和O3的质量均为48g,
则O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,
O3的物质的量为$\frac{48g}{48g/mol}$=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1,
故答案为:3:2;1:1.
点评 本题考查物质的量有关计算,侧重考查学生计算能力,明确各个物理量之间关系是解本题关键,注意:相同质量的同素异形体其原子个数相等,题目难度不大.

练习册系列答案
相关题目
2.下列有关物理量相应的单位表达中,错误的是( )
| A. | 摩尔质量g/mol | B. | 气体摩尔体积L/mol | ||
| C. | 溶解度g/100g | D. | 物质的量浓度mol/L |
19.下列变化与氧化还原反应无关的是( )
| A. | 钢铁冶炼 | B. | 汽油燃烧 | C. | 酸碱中和 | D. | 食物腐败 |
6.如图为用球棍模型表示的某有机反应过程的示意图,该反应的类型是( )


| A. | 取代反应 | B. | 加成反应 | C. | 聚合反应 | D. | 氧化反应 |
16.阻燃剂氢氧化铝受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,起到防火作用.下列关于该阻燃剂防火原因的分析中错误的是( )
| A. | 氢氧化铝受热分解时吸收燃烧物表面的热量 | |
| B. | 氢氧化铝分解生成的水蒸气稀释燃烧物表面的氧气 | |
| C. | 氢氧化铝受热分解吸收热量使可燃物的着火点降低 | |
| D. | 氢氧化铝分解生成的氧化铝覆盖在燃烧物表面,使燃烧物与O2隔绝 |
20.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
14.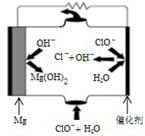 利用所学知识回答下列问题
利用所学知识回答下列问题
Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
(4)室温下,0.1mol/L Na2CO3溶液的pH>0.1mol/LNa2SO3溶液的pH(选填“>”、“<”或“=”).
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
 利用所学知识回答下列问题
利用所学知识回答下列问题Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).