题目内容
8.某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,中和反应都是放热反应,其实质是酸电离出的H+与碱电离出的OH-结合生成弱电解质水:H++OH-═H2O.分析 当反应物的总能量大于生成物的总能量时,反应放热;所有的中和反应均为放热反应;而酸碱中和的实质是氢离子和氢氧根反应生成水,以此解答该题.
解答 解:某化学反应,设反应物的总能量为E1,生成物的总能量为E2,而当反应物的总能量大于生成物的总能量时,故若E1>E2,反应为放热反应;所有的中和反应均为放热反应;而酸碱中和的实质是氢离子和氢氧根反应生成水,即:H++OH-═H2O.
故答案为:放;放;酸电离出的H+与碱电离出的OH-结合生成弱电解质水:H++OH-═H2O.
点评 本题考查反应热与焓变,为高频考点,侧重考查双基知识,题目涉及反应吸放热和反应物、生成物的总能量的关系以及常见的吸放热反应,难度不大,注意基础的掌握.

练习册系列答案
相关题目
19.在一密闭容器中,反应 mA(g)?nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
16.甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 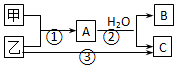

| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
20.为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1mol•L-1的KI溶液于试管,滴加0.1mol•L-1的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:2Fe3++2I-=2Fe2++I2
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1mol•L-1的KSCN溶液5~6滴,振荡,未见溶液呈血红色.
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度.针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大.
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
步骤1:取8mL0.1mol•L-1的KI溶液于试管,滴加0.1mol•L-1的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:2Fe3++2I-=2Fe2++I2
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1mol•L-1的KSCN溶液5~6滴,振荡,未见溶液呈血红色.
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度.针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大.
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
| 实验操作 | 预期现象 | 结论 |
| 实验1:在试管A加入少量乙醚,充分振荡,静置 | 乙醚层呈红色 | “猜想一”不成立 |
| 实验2:取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 | 若产生蓝色沉淀 | 则“猜想二”成立 |
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
18.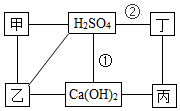 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |