题目内容
18.数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.(1)工业上常采用水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的化学方程式是C+H2O=CO+H2
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;反应生成的气体在加热、催化剂作用条件下可合成液体燃料甲醇,该反应的化学方程式为CO+2H2$\frac{\underline{\;一定温度\;}}{催化剂}$CH3OH.
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O (g)该条件下,该反应能够自发进行的原因是该反应△H<0.
(4)CO-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.该电池正极的电极反应式为O2+4e-=2O2-.
(5)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:
CH3OH(g)+CO(g)$?_{加热}^{催化剂}$HCOOCH3(g)△H=-29.1kJ•mol-1
科研人员对该反应进行了研究,部分研究结果如下:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,工业制取甲酸甲酯应选择的压强为b.
a.3.5×106Pa b.4.0×106Pa c.5.0×106Pa
②实际工业生产中采用的温度是80℃,其理由是温度低于80℃,反应速率较小;温度高于80℃,升温对反应速率影响较小,且该反应放热,升高温度平衡逆向移动,转化率降低.
分析 (1)水蒸气喷到灼热的炭层上发生反应生成CO和H2;
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;一氧化碳和氢气,在一定条件下合成甲醇,据此书写方程式;
(3)依据自发进行的判断依据△H-T△S<0分析;
(4)CO一空气燃料电池,氧气在正极得电子发生还原反应;
(5)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
解答 解:(1)水蒸气喷到灼热的炭层上发生反应生成CO和H2,则该反应的化学方程式是C+H2O=CO+H2,故答案为:C+H2O=CO+H2;
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;
一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2$\frac{\underline{\;一定温度\;}}{催化剂}$CH3OH;
故答案为:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2$\frac{\underline{\;一定温度\;}}{催化剂}$CH3OH;
(3)CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
(4)CO一空气燃料电池,氧气在正极得电子发生还原反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池正极的电极反应式为:O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(5)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率较大的是4.0×106Pa,故选:b;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,所以实际工业生产中采用的温度是80℃,故答案为:80℃;温度低于80℃,反应速率较小;温度高于80℃,升温对反应速率影响较小,且该反应放热,升高温度平衡逆向移动,转化率降低.
点评 本题主要考查了电极方程式及其化学方程式的书写、图象分析判断,题目难度中等,重在培养学生能够利用化学知识提取题干的信息进行答题的能力,综合性强,难度较大.

| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
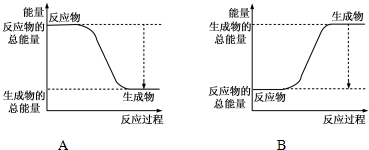
(1)已知反应2H2+O2=H2O为放热反应,下图能正确表示该反应中能量变化的是A.
从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相
同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作造成测定结果偏高的是AC
A.盛装未知液的锥形瓶先用蒸馏水洗过,再用未知液润洗
B.滴定终点读数时,俯视滴定管刻度,其他操作正确.
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,酸式滴定管尖嘴无气泡,滴定后有气泡
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入酚酞做指示剂.
B、用待测定的溶液润洗碱式滴定管.
C、用蒸馏水洗干净滴定管.
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E、检查滴定管是否漏水.
F、另取锥形瓶,再重复操作一次.
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→C→B→A→D→G→F
(2)氧化还原滴定--为了分析某残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行滴定,反应的离子方程式5Fe2++MnO${\;}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O
①KMnO4标准溶液应盛装在酸式滴定管中(填“酸式”或“碱式”)
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,每次移取25.00mL试样溶液,用1.000×10-2 mol•L-1 KMnO4标准溶液滴定.四次实验消耗标准溶液的体积分别为19.90mL、20.00mL、20.10mL、20.60mL.计算该残留物中铁元素的质量分数是4.480%.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是C.
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
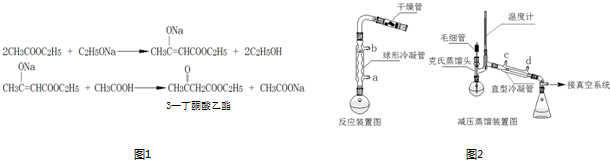
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.
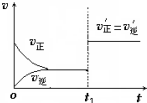 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).