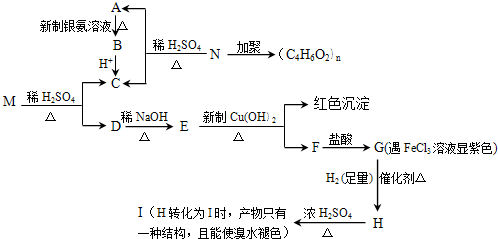
题目内容
碘化钠通常用作分析试剂,可用于医疗、照相业,通常易被氧化、潮解.工业上用铁屑还原法制备碘化钠,某研究性学习小组的同学们模拟了该过程,其流程如图:
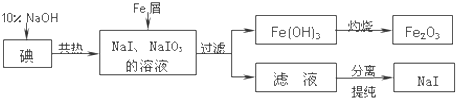
(1)判断碘是否已完全反应的实验方法是 ;
(2)加入铁屑发生的离子方程式 ;灼烧时发生的化学反应方程式 .
(3)测定产品中NaI含量的方法是:a.称取3.000g样品、溶解,在250mL容量瓶中定容; b.量取25.00mL待测溶液于锥形瓶中;c.用0.1000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00mL.
①上述测定过程所需仪器中,需要检查是否漏液的仪器有 .
②上述样品中NaI的质量分数为 .
③若用上述方法测定产品中NaI的质量分数偏低,试分析其可能原因有 、 (任写2条即可)

(1)判断碘是否已完全反应的实验方法是
(2)加入铁屑发生的离子方程式
(3)测定产品中NaI含量的方法是:a.称取3.000g样品、溶解,在250mL容量瓶中定容; b.量取25.00mL待测溶液于锥形瓶中;c.用0.1000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00mL.
①上述测定过程所需仪器中,需要检查是否漏液的仪器有
②上述样品中NaI的质量分数为
③若用上述方法测定产品中NaI的质量分数偏低,试分析其可能原因有
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,氢氧化铁灼烧分解生成氧化铁.
(1)根据淀粉遇碘变蓝色判断;
(2)铁具有还原性,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁结合得失电子守恒配平;氢氧化铁灼烧分解生成氧化铁和水;
(3)测定产品中NaI含量,滴加硝酸银,根据硝酸银的物质的量可确定质量分数,注意仪器的使用方法.
(1)根据淀粉遇碘变蓝色判断;
(2)铁具有还原性,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁结合得失电子守恒配平;氢氧化铁灼烧分解生成氧化铁和水;
(3)测定产品中NaI含量,滴加硝酸银,根据硝酸银的物质的量可确定质量分数,注意仪器的使用方法.
解答:
解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,氢氧化铁灼烧分解生成氧化铁;
(1)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应;
(2)铁具有还原性,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,反应的离子方程式为:故答案为:2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,氢氧化铁灼烧分解生成氧化铁和水方程式为:2Fe(OH)3
Fe2O3+3H2O,故答案为:2Fe+IO3-+3H2O=2Fe(OH)3↓+I-;2Fe(OH)3
Fe2O3+3H2O;
(3)①配制溶液用250mL容量瓶,滴定用酸式滴定管,都应检查是否漏液,故答案为:250 mL容量瓶、酸式滴定管;
②n(NaI)=n(AgNO3)=0.1mol/L×0.019L=0.0019mol,
则3.000g样品中含有n(NaI)=0.019mol,m(NaI)=0.019mol×150g/mol=2.85g,
ω(NaI)=
=95.00%,
故答案为:95.00%;
③若用上述方法测定产品中NaI的质量分数偏低,可考虑样品的原因,两种情况,一是样品被氧化,二是样品吸水,
故答案为:样品在空气中被氧化;样品在空气中吸水.
(1)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应;
(2)铁具有还原性,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,反应的离子方程式为:故答案为:2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,氢氧化铁灼烧分解生成氧化铁和水方程式为:2Fe(OH)3
| ||
| ||
(3)①配制溶液用250mL容量瓶,滴定用酸式滴定管,都应检查是否漏液,故答案为:250 mL容量瓶、酸式滴定管;
②n(NaI)=n(AgNO3)=0.1mol/L×0.019L=0.0019mol,
则3.000g样品中含有n(NaI)=0.019mol,m(NaI)=0.019mol×150g/mol=2.85g,
ω(NaI)=
| 2.85 |
| 3 |
故答案为:95.00%;
③若用上述方法测定产品中NaI的质量分数偏低,可考虑样品的原因,两种情况,一是样品被氧化,二是样品吸水,
故答案为:样品在空气中被氧化;样品在空气中吸水.
点评:本题考查物质制备实验,明确制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及碘的特性,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、11H2O.12H2O.13H2O互为同位素 |
| C、目前人们已发现的元素种类数目与原子种类数目相同 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较高 |
下列关于电解质溶液的叙述正确的是( )
| A、NaAlO2溶液、NaHCO3溶液加热蒸干后均得不到原溶质 | ||
| B、稀释醋酸溶液,溶液中所有离子的浓度均降 | ||
C、0.1mol/L的醋酸溶液加水稀释后,溶液中的
| ||
| D、0.1 mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
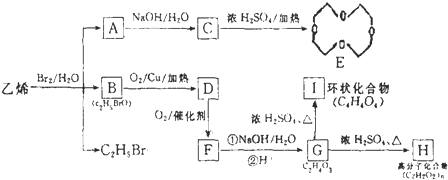
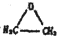 的结构可简写为
的结构可简写为 ,则E的化学式是
,则E的化学式是