题目内容
20.铜与浓硫酸加热时产生SO2,是因为浓硫酸具有( )| A. | 强酸性 | B. | 吸水性 | C. | 脱水性 | D. | 强氧化性 |
分析 铜与浓硫酸在加热时生成硫酸铜、二氧化硫和水,依据浓硫酸在反应中硫元素化合价变化判断浓硫酸性质.
解答 解:铜与浓硫酸在加热时生成硫酸铜、二氧化硫和水,浓硫酸在反应中部分硫元素化合价从+6价降为二氧化硫中+4价的硫,表现浓硫酸的强的氧化性,
故选:D.
点评 本题考查了浓硫酸的性质,明确浓硫酸在反应中元素化合价变化及浓硫酸的性质是解题关键,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
10.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
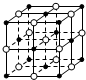

| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
11.下列有关NaHCO3与Na2CO3的性质说法中,正确的是( )
| A. | 相同温度时,Na2CO3 的溶解度小于NaHCO3 的溶解度 | |
| B. | 除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法 | |
| C. | 与同浓度稀盐酸反应,NaHCO3放出气泡的速率更快 | |
| D. | 将二者配成溶液,再分别滴加Ca(OH)2溶液,无白色沉淀生成的是NaHCO3 |
8.下列有关说法中正确的是( )
| A. | 铁与Cl2、盐酸均能发生反应生成FeCl3 | |
| B. | 加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多 | |
| D. | 常温下铁片、铝片与浓硫酸不能发生化学反应 |
15.下列物质中,属于纯净物的是( )
| A. | 矿泉水 | B. | 盐酸 | C. | 液氨 | D. | 漂白粉 |
12.将Na、Na2O2、K、Na2O四种固体分别和水反应,所产生的气体有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.下列有机物的结构、性质有关叙述正确的是( )
| A. | 分子式为C5H10O2,一定能与金属钠反应放出气体 | |
| B. | 甲苯分子中所有原子可能共面 | |
| C. | 生物柴油在NaOH溶液水解可得一种羧酸盐 | |
| D. | 乙醇、甲苯、葡萄糖能使酸性高锰酸钾溶液褪色 |
20.据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2═2ZnO,其原料为锌、空气和碱性电解质溶液,则下列叙述正确的是( )
| A. | 锌为正极,空气在负极反应 | |
| B. | 负极还原反应,正极氧化反应 | |
| C. | 负极的电极反应为:Zn+2OH--2e-═ZnO+H2O | |
| D. | 电池工作时溶液的pH 升高 |