题目内容
18.下列变化不可能通过一步反应直接完成的是( )| A. | Fe2O3→Fe(OH)3 | B. | Al(OH)3→Al2O3 | C. | SO3→H2SO4 | D. | Fe3+→Fe(OH)3 |
分析 A.氧化铁不溶于水,不能一步反应生成氢氧化铁;
B.氢氧化铝受热分解生成氧化铝和水;
C.三氧化硫溶于水生成硫酸;
D.铁离子和氢氧化钠溶液反应生成氢氧化铁沉淀.
解答 解:A.氧化铁不溶于水,不能一步反应生成氢氧化铁,需要先溶于酸转化为铁盐,再和碱溶液反应生成氢氧化铁,故A符合;
B.氢氧化铝受热分解生成氧化铝和水,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,反应一步能实现,故B不符合;
C.三氧化硫是溶于水的酸性氧化物溶于水生成硫酸,SO3+H2O=H2SO4,反应一步能实现,故C不符合;
D.铁离子和氢氧化钠溶液反应生成氢氧化铁沉淀,Fe3++3OH-=Fe(OH)3↓,反应一步能实现,故D不符合;
故选A.
点评 本题考查了元素化合物性质的理解应用,根据物质的性质来选择合适的转化方式,是对课本基础知识的考查,难度不大.

练习册系列答案
相关题目
20.化学与生活密切相关,下列生活中的常见物质按酸碱性的一定顺序依次排列正确的是( )
| A. | 厕所清洁剂、醋、肥皂、厨房清洁剂 | B. | 厕所清洁剂、厨房清洁剂、醋、肥皂 | ||
| C. | 醋、厕所清洁剂、肥皂、厨房清洁剂 | D. | 厨房清洁剂、醋、肥皂、厕所清洁剂 |
9.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示.若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示.下列叙述正确的是( )
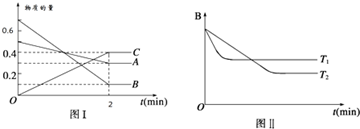

| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | 图(I)中,达平衡时,A的体积分数为37.5% |
3.在以离子键为主的化学键中常含有共价键的成分,两种元素电负性差异越小,其共价键成分越大.下列各对原子形成的化学键中共价键成分最多的是( )
| A. | K与F | B. | Na与F | C. | Al与Cl | D. | Mg与Cl |
10.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
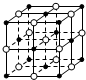

| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
7.下列物质的鉴别方法正确的有( )
| A. | 用硝酸银溶液区分碳酸钠和氯化钠 | |
| B. | 用硝酸钡溶液区分碳酸钠和硫酸钠 | |
| C. | 用氯化钙溶液区分碳酸钠和碳酸氢钠 | |
| D. | 用盐酸区分氢氧化钠和氯化钠 |
8.下列有关说法中正确的是( )
| A. | 铁与Cl2、盐酸均能发生反应生成FeCl3 | |
| B. | 加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多 | |
| D. | 常温下铁片、铝片与浓硫酸不能发生化学反应 |