题目内容
1.下列液体均处于25℃,有关叙述正确的是( )| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃时,用pH试纸测定出某醋酸溶液的pH=3.50 | |
| D. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
分析 A、溶液pH小于7的溶液有酸、强酸弱碱盐以及强酸的酸式盐等;
B、根据PH大小可计算出溶液中H+浓度,pH=4.5,c(H+)=10-4.5 mol•L-1,pH=6.5,其c(H+)=10-6.5 mol•L-1;
C.NH4Cl溶液中铵根离子水解显酸性;用广泛pH试纸测得PH为整数;
D.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,说明水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
解答 解:A、某些强酸的酸式盐如NaHSO4溶液的pH<7,故A错误;
B.PH=4.5的番茄汁与pH=6.5的牛奶中c(H+)分别为10-4.5mol•L-1、10-6.5mol•L-1,可见前者c(H+)是后者的100倍,故B正确;
C.25℃时,用pH试纸测定出某醋酸溶液的pH应为整数,故C错误;
D.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,说明水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,如呈碱性,酸溶液中AlO2-离子不能大量共存,故D错误;
故选B.
点评 本题考查了电解质溶液中的有关知识,包括盐类的水解、溶液的pH与c(H+)的关系的判断应用.做题时注意盐溶液类型的积累,对溶液浓度不同类型计算方法的整理以及水的平衡移动的影响条件的理解,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
3.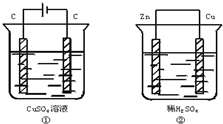 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
20.下列各组物质按单质、化合物、混合物顺序排列的是( )
| A. | 生石灰、硫、熟石灰 | B. | 液态氧、胆矾、Fe(OH)3胶体 | ||
| C. | 铁、浓硫酸、氯化氮 | D. | 氮气、碘酒、碱式碳酸铜 |
6.下列各化合物的命名正确的是( )
| A. | CH2═CH-CH═CH21,3-二丁烯 | B. | CH2BrCH2Br 二溴乙烷 | ||
| C. | CH3CH2CH(OH)CH33-丁醇 | D. |  2-甲基丁烷 2-甲基丁烷 |
13.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. |  间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-丁醇 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
10.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 7.8gNa2O2中含有的阴离子数目为0.2Na | |
| B. | 标准状况下,2.24LCHCl3的分子数为0.1NA | |
| C. | 0.1molFe与足量稀HNO3反应,转移电子数为0.3NA | |
| D. | 1L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA |
11. Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )| 选项 | A | B | C | D |
| a | Na | Al | Fe | Cu |
| b | NaOH | Al2O3 | FeCl3 | CuSO4 |
| c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
 ,
, ,
,