题目内容
6. 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.(1)A烧杯中反应的离子方程式为Zn+2H+═Zn2++H2↑.
(2)B中Zn板是负极,发生的电极反应是Zn-2e-═Zn2+,Cu板上的现象是有无色气体产生,发生的电极反应是2H++2e-═H2↑.
(3)从能量转化的角度来看,A、B中反应物的总能量大于(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为热能,B中主要是将化学能转变为电能.
(4)该小组同学反思原电池的原理,其中观点正确的是ABD(填字母序号).
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生.
分析 (1)锌与氢离子反应生成锌离子与氢气;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,锌失电子发生氧化反应,氢离子在正极铜上得电子发生还原反应;
(3)A烧杯中温度升高,该反应是放热反应;原电池将化学能转化成电能;
(4)A.原电池的本质是有电子转移;
B.原电池的构成条件必须有两个电极;
C.活泼金属作负极失电子发生氧化反应;
D.负极发生氧化反应,正极发生还原反应.
解答 解:(1)锌与氢离子反应生成锌离子与氢气,离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,电极反应为Zn-2e-═Zn2+,氢离子在正极铜上得电子产生氢气,电极反应为2H++2e-═H2↑,
故答案为:负;Zn-2e-═Zn2+;有无色气体产生;2H++2e-═H2↑;
(3)A烧杯中温度升高,该反应是放热反应,所以反应物总能量大于生成物总能量;该反应将化学能转化成热能,原电池是将化学能转化成电能,
故答案为:大于;热能;电能;
(4)A.原电池要有自发进行的氧化还原反应发生,一定有电子的转移,故A正确;
B.原电池的构成条件必须有两个电极,故B正确;
C.活泼金属作负极失电子发生氧化反应,正极上得电子发生还原反应,一般负极溶解,正极质量增重或析出气体,故C错误;
D.负极发生氧化反应,正极发生还原反应,故D正确;
故答案为:ABD.
点评 本题考查了反应热、原电池原理等知识点,明确反应物和生成物能量相对大小与反应热的关系、原电池构成条件即可解答,题目难度不大.

练习册系列答案
相关题目
16.高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g)?Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{C(C{O}_{2})}{C(CO)}$,△H<(填“>”“<”或“=”)0.
(2)在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1、CO的平衡转化率=60%.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol•L-1和0.1mol•L-1,则此时反应是否达到平衡否(填“是”或“否”),V(正)>V(逆)(填“>”“<”或“=”)
已知该反应在不同温度下的平衡常数如右表所示:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{C(C{O}_{2})}{C(CO)}$,△H<(填“>”“<”或“=”)0.
(2)在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1、CO的平衡转化率=60%.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol•L-1和0.1mol•L-1,则此时反应是否达到平衡否(填“是”或“否”),V(正)>V(逆)(填“>”“<”或“=”)
17.化学与社会、生活密切相关.下列做法中错误的是( )
| A. | 用食醋浸泡可除去水垢 | |
| B. | 用浓烧碱溶液作蚊虫叮咬处的淸洗剂 | |
| C. | 用明矾溶液的酸性淸除铜镜表面的铜锈 | |
| D. | 用浸泡过高锰酸钾溶液的硅土保存水果 |
14.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
1.依据元素周期表判断,下列各组关系中正确的是( )
| A. | 稳定性:NH3>H2O>H2S | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:Mg(OH)2>Ca(OH)2>Ba(OH)2 |
11. 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
| A. | 向a点溶液中滴加BaCl2溶液,无明显现象 | |
| B. | b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+ | |
| C. | c点溶液中发生的主要反应:2Fe3++3SO32-+6H2O?2Fe( OH)3+3H2SO3 | |
| D. | 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深 |
18.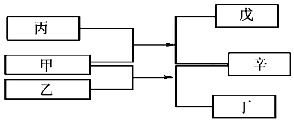 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
15.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,X是周期表中原子半径最小的元素,Y的最高正价与最低负价绝对值相等,W最外层电子数是最内层电子数的3倍,R是同周期元素中原子半径最小的元素.下列说法不正确的是( )
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
16.下列说法不正确的是( )
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |