题目内容
3.对下列物质:①H2SO4、②CaO、③NaOH、④熔融BaSO4、⑤盐酸、⑥SO2、⑦氨水、⑧C2H5OH、⑨Cu、⑩氯化钠溶液按要求分类(填写序号)(1)电解质:①②③④;
(2)非电解质:⑥⑧;
(3)能导电的:④⑤⑦⑨⑩;
(4)纯净物且水溶液能导电:①②③⑥.
分析 (1)电解质是在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
(2)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(3)能导电的物质中含有自由移动的电子或离子;
(4)纯净物只由一种物质组成,据此即可解答.
解答 解:(1)电解质包括酸、碱、盐、活泼金属氧化物和水,所以①H2SO4、②CaO、③NaOH、④熔融BaSO4是电解质;
故答案为:①②③④;
(2)非电解质包括一些非金属氧化物、氨气、大多数有机物等,所以⑥SO2、⑧C2H5OH是非电解质,故答案为:⑥⑧;
(3)④熔融BaSO4、⑤盐酸、⑦氨水、⑩氯化钠溶液中含有自由移动的离子,所以能导电,⑨Cu含有自由移动的电子,所以能导电;
故答案为:④⑤⑦⑨⑩;
(4)①H2SO4、②CaO、③NaOH、⑥SO2都是纯净物,且水溶液中含有自由移动的离子而导电,故答案为:①②③⑥.
点评 本题考查物质的分类以及物质导电的原因,解答时应对概念十分清晰.抓住概念中的关键词,并注意大多数有机化合物都是非电解质,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
14.若初始时在恒容密闭容器中加入N2O5,表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
11.无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)$\frac{\underline{\;高温\;}}{\;}$4AlCl3(g)+3O2(g)△H>0.下列分析错误的是( )
| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
8.下列实验操作中有错误的是( )
| A. | 、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 在分液漏斗中进行萃取操作时应该边振荡边放气 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 过滤时,用玻璃棒轻轻搅拌以加速过滤 |
15.已知:2H2O2(l)═2H2O(l)+O2(g)△H=-98kJ•mol-1.在含少量I-的溶液中,H2O2分解反应过程为:
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |
12. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
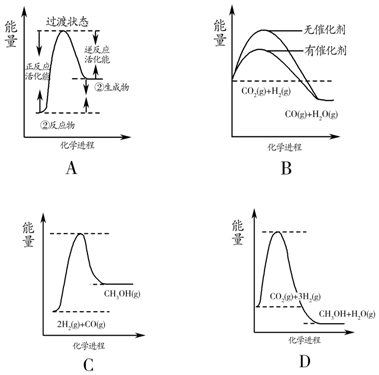
(5)根据表格测得焓变,下列能量关系图合理的是AD.
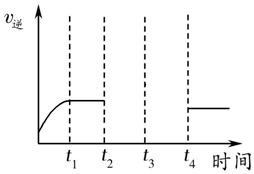
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2 (用K1、K2表示),
△H3═△H1+△H2 (用△H1、△H2表示);根据反应③判断△S<0(填“>”、“=”或“<”),在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有ADF(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.降低温度 E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.3mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正<v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是AD.

(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
13.下列离子方程式正确的是( )
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
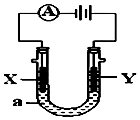 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: