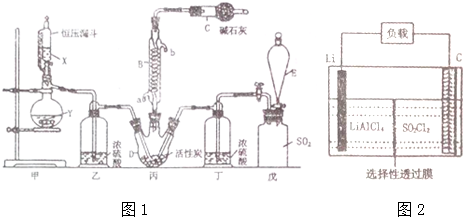
题目内容
16.实验室常用下图装置进行铜与浓硫酸反应的实验,下列有关实验现象的描述或试剂的选用错误的是( )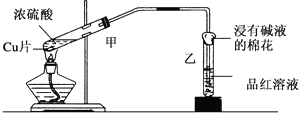
| A. | 甲试管内溶液变为蓝色 | |
| B. | 乙试管中品红溶液红色褪去 | |
| C. | 棉花上喷入的溶液可能为氢氧化钠溶液 | |
| D. | 棉花上喷入的溶液可能为饱和碳酸钠溶液 |
分析 A.加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O,且试管中剩余浓硫酸具有吸水性;
B.SO2能和有色物质反应生成无色物质而具有漂白性;
C.SO2有毒,不能直接排空,SO2为酸性氧化物,能和碱性物质反应;
D.SO2有毒,不能直接排空,SO2为酸性氧化物,能和碱性物质反应.
解答 解:A.加热条件下,Cu和浓硫酸反应生成CuSO4、SO2和H2O,且试管中剩余浓硫酸具有吸水性,所以反应后A中溶液不是蓝色,将冷却后的A溶液倒入水中时,溶液呈蓝色,故A错误;
B.SO2能和有色物质反应生成无色物质而具有漂白性,二氧化硫能和品红反应生成无色物质而体现漂白性,故B正确;
C.SO2有毒,不能直接排空,SO2为酸性氧化物,能和碱性物质反应,NaOH具有碱性,符合条件,故C正确;
D.SO2有毒,不能直接排空,SO2为酸性氧化物,能和碱性物质反应,碳酸钠是强碱弱酸盐其水溶液呈碱性,符合条件,故D正确;
故选A.
点评 本题以铜和浓硫酸反应为载体考查学生实验操作、实验观察能力,明确物质性质是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.室温下,下列电解质溶液叙述正确的是( )
| A. | pH=11的Na2SO3溶液中,水电离的c(H+)=1.0×10-11mol/L | |
| B. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | 浓度相同的①NH4Cl②(NH4)2SO4③(NH4)2CO3④NH4HSO4四种溶液,c(NH4+)大小顺序为:②>③>④>① | |
| D. | pH=4的NaHC2O4溶液中存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) |
4.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol•L-1K2SO4溶液中含有K+的数目为2NA | |
| B. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| C. | 18g重水中所含有的中子数为10NA | |
| D. | 1molNa与O2在一条条件下反应生成Na2O和Na2O2的混合物的转移电子数为NA |
11.原子序数依次增大的短周期元素W、X、Y、Z分别位于不同的奇数主族,且它们的简单离子的电子层结构相同,下列叙述正确的是( )
| A. | W的单质的熔点最高 | B. | X元素的非金属性最强 | ||
| C. | Y的离子半径最小 | D. | Z的原子半径最大 |
7.甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
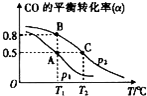 SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.
SO2、NO、NO2、CO都是污染大气的有害物质,对其进行回收利用是节能减排的重要课题.