题目内容
下列物质属于非电解质的是( )
| A、蔗糖溶液 |
| B、CO2 |
| C、Cu |
| D、KOH |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
解答:
解:A.蔗糖溶液是混合物,所以不是电解质,故A错误;
B、二氧化碳的水溶液能导电,原因是二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,二氧化碳是非电解质,故B正确;
C、铜是单质,所以铜既不是电解质也不是非电解质,故C错误;
D、KOH为化合物,其水溶液能导电,熔融也能导电,则KOH属于电解质,故D错误.
故选B.
B、二氧化碳的水溶液能导电,原因是二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而使溶液导电,碳酸是电解质,二氧化碳是非电解质,故B正确;
C、铜是单质,所以铜既不是电解质也不是非电解质,故C错误;
D、KOH为化合物,其水溶液能导电,熔融也能导电,则KOH属于电解质,故D错误.
故选B.
点评:本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
将镁和铝的混合物5.1g投入500mL 2mol/L稀盐酸中,生成氢气0.5g;再加入4mol/L的NaOH溶液,当生成沉淀的质量最多时,加入NaOH溶液的体积与沉淀质量的最大值均正确的是( )
| A、250 mL、13.6 g |
| B、500 mL、5.6 g |
| C、125 mL、10.2 g |
| D、1000 mL、7.8 g |
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(s)+bB(g)?cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )
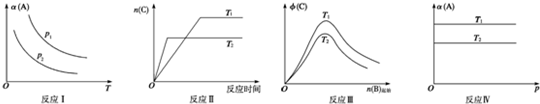

| A、反应Ⅰ:若p1<p2,则a+b<c |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应Ⅲ:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
下列电解质的水溶液直接蒸干以后可以得到原电解质纯净物的是( )
| A、MgCl2 |
| B、Na2SO3 |
| C、NaHCO3 |
| D、Na2CO3 |
已知一定条件下断裂或生成某些化学键的能量关系如下表:对于反应:H2(g)+Cl2 (g)=2HCl (g),下列说法正确的是( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、该反应的反应热△H>0 |
| B、生成1mol HCl时反应放热91.5kJ |
| C、Cl2中的化学键比H2中的化学键更稳定 |
| D、相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
下列事实中不能用勒夏特列原理来解释的是( )
| A、向H2S水溶液中加入NaOH固体有利于S2-增多 |
| B、鼓入过量空气有利于SO2转化为SO3 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH- (aq)=H2O(l)△H=-57.3KJ/mol,向1L 0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是( )
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H2>△H1>△H3 |
| D、△H1>△H3>△H2 |
铀-235是铀元素的一种放射性核素.下列关于
U的说法正确的是( )
235 92 |
| A、中子数为92 |
| B、质子数为143 |
| C、核外电子数为143 |
| D、质量数为235 |
下列叙述或离子方程式书写正确的是( )
| A、将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | ||||
| B、向含有Fe2O3悬浊液中通入HI气体:Fe2O3+6H+=2Fe3++3H2O | ||||
C、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| D、等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3?H2O |