题目内容
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(s)+bB(g)?cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,?表示体积分数).根据图象,下列判断正确的是( )
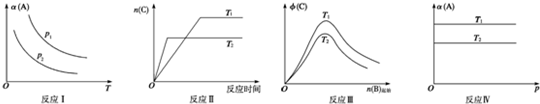

| A、反应Ⅰ:若p1<p2,则a+b<c |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应Ⅲ:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
考点:体积百分含量随温度、压强变化曲线,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:A、反应aA(s)+bB(g)?cC(g)中A为固体,和压强无关;
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,据此判断;
C、根据温度对平衡移动的影响判断;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,据此判断.
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,据此判断;
C、根据温度对平衡移动的影响判断;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,据此判断.
解答:
解:A、反应aA(s)+bB(g)?cC(g)中A为固体,和压强无关,不能根据压强判断a+b与c的关系,故A错误;
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,故B正确;
C、如果反应III中△H>0,要使生成物C的体积分数增大,则应当是T2<T1,故C错误;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,△H<0,该反应容易自发,故D错误;
故选B.
B、由图可知,T2的起始斜率大于T1,说明T1<T2,升高温度,C的物质的量减小,平衡逆向移动,说明正反应是放热反应,故B正确;
C、如果反应III中△H>0,要使生成物C的体积分数增大,则应当是T2<T1,故C错误;
D、温度越高,反应物的转化率越低,说明该反应为放热反应,△H<0,该反应容易自发,故D错误;
故选B.
点评:本题主要考查了根据图象判断反应的特征,中等难度,解题时要注意观察图以及基础本原理的应用.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
能检验某溶液中有Fe2+无Fe3+的实验事实是( )
| A、向溶液中加入2滴KSCN溶液立即变红色 |
| B、向溶液中加入少许氯水后再加2滴KSCN溶液立即变红色 |
| C、向溶液中加入2滴KSCN溶液无明显变化,再加入少许氯水立即变红色 |
| D、向溶液中加入少许NaOH溶液立即产生红褐色沉淀 |
有机物A的分子式为C8H16O2,在酸性条件下A能水解为甲和乙两种有机物,甲在一定的条件下可以催化氧化得到乙,则A的可能结构有( )
| A、2种 | B、4种 | C、6种 | D、8种 |
在指定环境中,下列各组离子可以大量共存的是( )
| A、在澄清透明的无色溶液中:Cl-、MnO4-、Al3+、SO42-、Ca2+ |
| B、在强酸性溶液中:Na+、SO42-、NO3-、HCO3-、NH4+ |
| C、在强碱性溶液中:SO32-、K+、Na+、CO32-、CH3COO- |
| D、使石蕊试纸变蓝的溶液中:Cu2+、NO3-、Na+、SO42-、Ag+ |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A、NaOH、H2SO4、Ba(OH)2 |
| B、NaOH、CuSO4、H2SO4 |
| C、HCl、CuCl2、Ba(OH)2 |
| D、NaBr、H2SO4、Ba(OH)2 |
已知三种一元弱酸的电离常数大小如下:Ka(HX)>Ka(HY)>Ka(HZ);常温下pH相等的下列三种溶液:NaX、NaY、NaZ,其物质的量浓度从大到小的顺序正确的是( )
| A、c(NaX)>c(NaY)>c(NaZ) |
| B、c(NaZ)>c(NaY)>c(NaZ) |
| C、c(NaX)>c(NaZ)>c(NaY) |
| D、c(NaZ)>c(NaX)>c(NaY) |
下列物质属于非电解质的是( )
| A、蔗糖溶液 |
| B、CO2 |
| C、Cu |
| D、KOH |