题目内容
7.含氰化物(有CN-)的废水危害大,CN-的含量为0.01mol/L~0.04mol/L就能毒死鱼类.处理它的方法是用氯氧化法使其转化为低毒的氰酸盐(含CNO-),氧化剂常用次氯酸盐,且进一步可降解为无毒的气体.近期研究将把某些半导体的小粒悬浮在溶液中,在光的作用下,在小粒和溶液界面发生氧化还原反应.但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物.(1)二氧化钛在上述反应中的作用是催化作用;
(2)氰化物经处理后产生的无毒气体应该是CO2和N2.
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O.
分析 由信息可知,发生KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O,若氧化剂为NaClO发生5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,以此来解答.
解答 解:(1)光的作用下,在小粒和溶液界面发生氧化还原反应.但小粒的质量不发生变化,如二氧化钛(TiO2)小粒表面就可以破坏氰化物有毒废物,可知二氧化钛在上述反应中的作用是催化作用,故答案为:催化;
(2)由KCN+2KOH+Cl2═KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O可知,氰化物经处理后产生的无毒气体应该是CO2、N2,故答案为:CO2;N2;
(3)若用NaClO溶液处理NaCN的废液,产生另外两种盐,其化学方程式为5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O,故答案为:5NaClO+2NaCN+2NaOH=2Na2CO3+N2↑+5NaCl+H2O.
点评 本题考查氧化还原反应及应用,为高频考点,侧重于学生的分析与应用能力的考查,把握习题中的信息及发生的反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
13.有一种银锌电池,其电极分别为Ag2O和ZnO,电解质溶液为KOH,电极反应式分别为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
14.下列各组化合物中,有关化学键类型的叙述正确的是( )
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
11.下列叙述正确的是( )
| A. | 苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却后溶液仍澄清透明 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaCHO3反应放出CO2 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
2.下列粒子中核外电子数相同的是( )
①Al3+ ②○2- ③Cl- ④F-.
①Al3+ ②○2- ③Cl- ④F-.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
12.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
19.下表列出了A~R九种元素在周期表的位置:
(1)写出EF2分子的电子式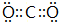 .
.
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
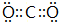 .
.(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族:
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.