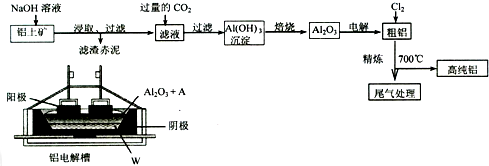
题目内容
12.下列说法正确的是( )| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
分析 A.原子最外层电子数为2的元素可为He;
B.主族元素X、Y能形成XY2型化合物,可能有CO2、SO2、NO2、MgCl2、CaCl2等;
C.HF含有氢键,沸点较高;
D.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小.
解答 解:A.原子最外层电子数为2的元素可为He,He为零族元素,故A错误;
B.主族元素X、Y能形成XY2型化合物,可能有CO2、SO2、NO2、MgCl2、CaCl2等,原子序数之差可能为2、8、3或5等,故B正确;
C.F的非金属性较强,HF含有氢键,沸点较高,故C错误;
D.第三周期中,阴离子半径大于阳离子半径,具有相同排布的离子原子序数大的离子半径小,如第三周期中铝离子半径最小,故D错误;
故选B.
点评 本题考查元素在周期表的位置及应用,为高频考点,把握原子结构与元素的位置、元素周期律的实质为解答的关键,侧重于学生的分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.把0.02mol/L CH3COOH溶液和0.01mol/LNaOH溶液等体积混合,溶液呈酸性,则混合溶液中微粒浓度关系不正确的是( )
| A. | c(CH3COO-)>c (Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.02mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(H+)=c (Na+)+c(OH-) |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,2.24LCH4中含有0.4NA个共价键 | |
| B. | 100mL1mol•L-1NaAlO2溶液中含有0.1NA个AlO2- | |
| C. | 常温常压下,5.6gFe与足量稀硝酸反应,转移电子0.2NA个电子 | |
| D. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 |
4.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C.
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的化学式:NH4+ (用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是H2CO3(填化学式),理由是H2CO3为弱酸,其它三种为强酸.Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为3H++Al(OH)3═Al3++3H2O.
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的化学式:NH4+ (用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是H2CO3(填化学式),理由是H2CO3为弱酸,其它三种为强酸.Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为3H++Al(OH)3═Al3++3H2O.
1.下列电子式正确的是( )
| A. | 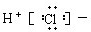 | B. | 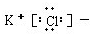 | C. | Cl:Cl | D. | 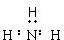 |
 能发生的反应类型.若能反应,则1mol该油脂最多消耗溴的物质的量是多少?
能发生的反应类型.若能反应,则1mol该油脂最多消耗溴的物质的量是多少?