题目内容
2.下列粒子中核外电子数相同的是( )①Al3+ ②○2- ③Cl- ④F-.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 阳离子的核外电子数=核电荷数-所带电荷,阴离子的核外电子数=核电荷数+所带电荷,据此进行解答.
解答 解:①Al3+的核电荷数为13,则核外电子数=13-3=10,;
②O2-的核电荷数为8,则核外电子数=8+2=10;
③Cl-的核电荷数为17,则核外电子数=17+1=18;
④F-的核电荷数为9,则核外电子数=9+1=10;
根据分析可知,核外电子数相同的为①②④,
故选C.
点评 本题考查了原子核外电子排布,题目难度不大,明确阴阳离子的核外电子数与核电荷数、所带电荷的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.下表是元素周期表的一部分,回答下列问题:
(1)写出②⑧⑩三种元素分别为N;Si;S.
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式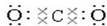 ,O=C=O.
,O=C=O.
(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式
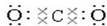 ,O=C=O.
,O=C=O.(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
9.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示,下列说法不正确的是( )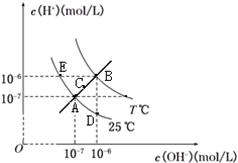

| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
6.下列有关性质的递变关系,正确的是( )
| A. | 离子半径:Na+<S2-<Cl-<K+ | B. | 还原性:I-<Br-<-Cl<F- | ||
| C. | 稳定性:SiH4<PH3<HCl<HBr | D. | 溶解性:BaO4<CaSO4<MgSO4. |
11.下列各种溶液中,可能大量共存的离子组是( )
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、I- | |
| B. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
12.最近科学家研制出一种新的分子,它具有类似白磷状结构,且分子中每个原子都满足8电子稳定结构,化学式为N4,下列说法正确的是( )
| A. | N4是一种新型化合物 | B. | N4和N2互为同素异形体 | ||
| C. | N4分子和N2一样含有N≡N | D. | N4中含极性共价键 |
 .
.