题目内容
4.MnO2和锌是制造锌锰电池的主要原料,一种新工艺采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为原料生产MnO2和锌,其简化工艺流程如下(中间产物的固体部分已经略去):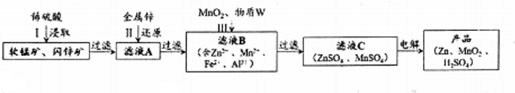
已知:
①浸取时发生的主要反应为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,杂质FeS、CuS、CdS也会发生类似反应.
②某些金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤Ⅰ中浸取时Al2O3与稀硫酸反应的化学方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(2)步骤Ⅱ中还原回收得到的金属单质是Cu、Cd.
(3)步骤Ⅲ中MnO2的作用是将Fe2+氧化成Fe3+,适宜选作物质W的试剂为BD(选填编号).
A.NaOH B.ZnO C.NH3•H2O D.MnCO3
(4)酸性锌锰干电池放电时,负极的电极反应式为Zn-2e-═Zn2+.
(5)MnSO4可用于制备MnCO3,MnCO3在空气中加热反应也可制得MnO2.
已知25℃,101kPa时:
Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1
MnCO3在空气中加热反应生成MnO2的热化学方程式为2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933kJ•mol-1.
(6)按照图示流程,若某次生产过程中使用了100t闪锌矿,其中ZnS含量为80%,浸取时ZnS的损失率为3%,最终得到87t MnO2.假设流程中每个步骤都反应完全,电解(使用惰性电极)时无其他产物生成,则流程中除杂质所引入的锌元素的质量为13t.
分析 软锰矿、闪锌矿和稀硫酸混合,发生的反应有MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、MnO2+FeS+2H2SO4=MnSO4+FeSO4+S↓+2H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+CdS+2H2SO4=MnSO4+CdSO4+S↓+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不溶于稀硫酸,然后过滤,滤液中含有MnSO4、FeSO4、CuSO4、CdSO4、Al2(SO4)3,向滤液中加入Zn,Zn能还原Cu2+、Cd2+得到Cu、Cd,过滤向滤液中加入二氧化锰和W,二氧化锰具有氧化性,能氧化还原性离子Fe2+,W能使溶液中铁离子、铝离子反应生成沉淀,则W能和氢离子反应且不能引进新的杂质;电解硫酸锌和硫酸锰溶液得到Zn、MnO2和稀硫酸;
(1)Al2O3是两性氧化物,能和H2SO4反应生成Al2(SO4)3和 H2O;
(2)根据流程图中反应前后离子变化确定回收金属成分;
(3)二氧化锰具有氧化性,能氧化还原性离子;
W能和氢离子反应而调节溶液的pH,且不能引进新的杂质;
(4)放电时负极上锌失电子发生氧化反应;
(5)根据盖斯定律写出该反应热化学方程式;
(6)闪锌矿浸取后m(Zn)=100t×80%×(1-97%)×$\frac{65}{97}$=52t,电解反应式为Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+,根据方程式中锌元素和二氧化锰之间的关系式计算需要Zn的质量.
解答 解:软锰矿、闪锌矿和稀硫酸混合,发生的反应有MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、MnO2+FeS+2H2SO4=MnSO4+FeSO4+S↓+2H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+CdS+2H2SO4=MnSO4+CdSO4+S↓+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不溶于稀硫酸,然后过滤,滤液中含有MnSO4、FeSO4、CuSO4、CdSO4、Al2(SO4)3,向滤液中加入Zn,Zn能还原Cu2+、Cd2+得到Cu、Cd,过滤向滤液中加入二氧化锰和W,二氧化锰具有氧化性,能氧化还原性离子Fe2+,W能使溶液中铁离子、铝离子反应生成沉淀,则W能和氢离子反应且不能引进新的杂质;电解硫酸锌和硫酸锰溶液得到Zn、MnO2和稀硫酸;
(1)Al2O3是两性氧化物,能和H2SO4反应生成Al2(SO4)3和 H2O,反应方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O,
故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O;
(2)根据流程图中反应前后离子变化确定回收金属成分为Cu、Cd,故答案为:Cu、Cd;
(3)二氧化锰具有氧化性,能氧化还原性离子亚铁离子,然后将铁离子除去;
W能和氢离子反应而调节溶液的pH,且不能引进新的杂质,符合条件的有BD,一水合氨和NaOH虽然能调节溶液的pH但引进新的杂质,
故答案为:将Fe2+氧化成Fe3+;BD;
(4)放电时负极上锌失电子发生氧化反应,电极反应式为Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
(5)Mn(s)+O2(g)=MnO2(s)△H1=-520kJ•mol-1 ①
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1 ②
2Mn(s)+2C(s)+3O2(g)=2MnCO3(s)△H3=-894kJ•mol-1③,
将方程式;2(①+②)-③得2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=2(-520kJ•mol-1-393.5kJ•mol-1 )-(-894kJ•mol-1)=-933 kJ•mol-1,
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-933 kJ•mol-1;
(6)闪锌矿浸取后m(Zn)=100t×80%×(1-97%)×$\frac{65}{97}$=52t,电解反应式为Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+,
设生成87t二氧化锰所需锌元素质量为x,
Zn 2++Mn 2++2H2O$\frac{\underline{\;电解\;}}{\;}$Zn↓+MnO2↓+4H+
65 87
x 87t
65:87=x:87t
x=$\frac{65×87t}{87}$=65t
实际上有52t,则还需要65t-52t=13t,
故答案为:13.
点评 本题考查物质分离和提纯,为高频考点,涉及化学方程式的计算、原电池原理、盖斯定律、除杂等知识点,侧重考查学生分析计算及知识的综合运用,明确化学原理、各个物理量之间的关系及流程图中发生的反应及可能存在的离子或物质是解本题关键,题目难度中等.

| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |

(1)滤渣A的成分除Co的磷酸盐和Fe(OH)3外还有Si (填化学式).
(2)加入Co3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成Co2+的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
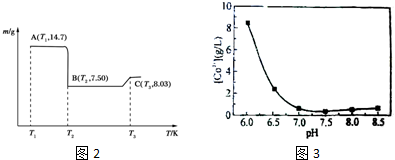
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图2:
写出C点物质的化学式:Co3O4.
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH(5.0,7.2),使Fe3+、Al3+ 沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;⑤400℃焙烧3h,得产品氧化钴.
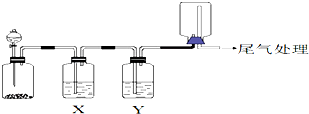
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
 ③
③ .
.

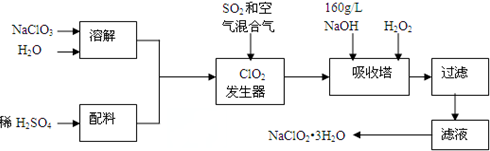
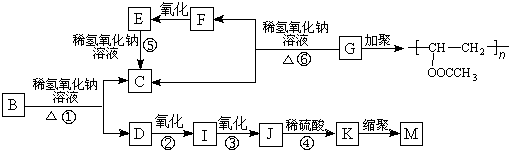
 .
.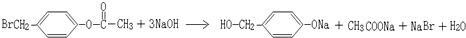 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: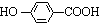 +NaOH→
+NaOH→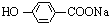 +H2O.
+H2O.