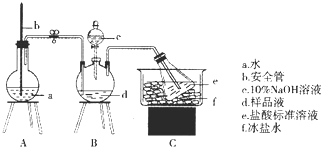
题目内容
16.25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,下列说法正确的是( )| A. | 该溶液中水电离出的c(H+)=10-8mol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(C1-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
分析 A、pH=a的CH3COONa溶液中,所有氢原子和氢氧根均来自于水的电离;
B、加水稀释,醋酸钠的水解平衡右移,水解被促进;
C、当pH=7时,c(H+)=c(OH-),根据电荷守恒和物料守恒来分析;
D、向溶液中加入醋酸显酸性,根据醋酸和醋酸钠的量的相对多少来分析.
解答 解:A、pH=a的CH3COONa溶液中,c(H+)=10-amol/L,c(OH-)=10a-14mol/L,而由于醋酸根水解结合了氢离子,故氢氧根能代表水电离出的全部,而水电离出的氢离子浓度和氢氧根的浓度相等,故溶液中水电离出的c(H+)=10a-14mol/L,故A错误;
B、加水稀释,醋酸钠的水解平衡右移,水解被促进,故醋酸钠的水解程度增大,但由于醋酸钠的浓度减小,故水的电离程度反而减小,故B错误;
C、加入盐酸后根据电荷守恒可知c(H+)+c(Na+)=c(CH3COO-)+c(OH-)+c(C1-),根据物料守恒可知:c(Na+)=c(CH3COO-)+c(CH3COOH),而当pH=7时,c(H+)=c(OH-),三式联立可知:c(C1-)=c(CH3COOH),故C正确;
D、向溶液中加入醋酸显酸性,根据醋酸和醋酸钠的量的相对多少可知,当醋酸钠的物质的量和醋酸的物质的量差不多时,有c(CH3COO-)>c(Na+)>c(H+)>c(OH-),但当醋酸的物质的量远大于醋酸钠时,可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选C.
点评 本题涉及盐的水解平衡移动的影响因素知识,助于化学平衡的移动原理的应用是关键,难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
6.对K2CO3分类,不正确的是( )
| A. | 属于钾盐 | B. | 属于碳酸盐 | C. | 属于正盐 | D. | 属于酸式盐 |
7.页岩气是从页岩层中开采出来的一种非常重要的非常规天然气资源,页岩气的主要成分是烷烃,其中甲烷占绝大多数,下列有关甲烷的说法正确的是( )
| A. | 既不是电解质也不是非电解质 | |
| B. | 甲烷燃烧的产物可导致酸雨 | |
| C. | 甲烷可以做燃料电池的燃料 | |
| D. | 等质量的不同烷烃充全燃烧,甲烷的耗氧最最少 |
4.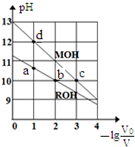 常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )
常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )
 常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )
常温下,向体积均为V0、浓度均为c mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-1g$\frac{{V}_{0}}{V}$的变化如图所示.下列叙述正确的是( )| A. | 碱性:MOH>ROH | |
| B. | b、c两点的溶液中:c(R+)>c(M+) | |
| C. | 溶液中水的电离程度α:αc>αb>αa>αd | |
| D. | c>0.1 |
11.下列有关物质性质的说法错误的是( )
| A. | 非金属性:Cl>I | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:H2SO3>H2SO4 | D. | 结合H+能力:CO32->Cl- |
1.下列说法正确的是( )
| A. | 食盐水、稀豆浆、蔗糖水都能产生丁达尔效应 | |
| B. | 14C可用于文物的鉴定,14C与12C互为同素异形体 | |
| C. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| D. | 黑火药含有硫磺、硝酸钾和木炭,其中硝酸钾是电解质,硫磺和木炭是非电解质 |
5.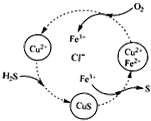 用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
 用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )| A. | 氢、氯、铜三元素的化合价未发生改变 | |
| B. | 转化过程中包含三步化学反应 | |
| C. | 转化过程中还原剂为H2S和FeCl2 | |
| D. | 总反应可表示为:2H2S+O2→2S+2H2O |
6.下列说法正确的是( )
| A. | 木糖醇( 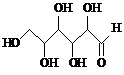 )和葡萄糖( )和葡萄糖(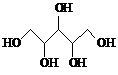 )互为同系物,均 )互为同系物,均属于糖类 | |
| B. | 分子式为C6H14的有机物其一氯代物有三种,此有机物可能是3,3-二甲基丁烷 | |
| C. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| D. | 等质量的乙烯、甲醚、碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量一定不相同 |