题目内容
8. A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、B、C、D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )| A. | B 的M层电子数是K层的3倍 | |
| B. | C 的离子具有与 Na+相同的电子层结构 | |
| C. | A 与 D 形成的化合物属于离子化合物 | |
| D. | C 的简单阴离子比 D 的简单阴离子还原性强 |
分析 A、B、C、D四种短周期元素在周期表中的位置如图所示,结合元素周期表结构可知D位于第二周期,A、B、C位于第三周期;其中C的原子序数是D的原子序数的2倍,C比D的原子序数大8,则D为O、C为S元素;结合各元素的相对位置可知,B为P元素、A为Si元素,据此结合元素周期律知识解答.
解答 解:A、B、C、D四种短周期元素在周期表中的位置如图所示,结合元素周期表结构可知D位于第二周期,A、B、C位于第三周期;其中C的原子序数是D的原子序数的2倍,C比D的原子序数大8,则D为O、C为S元素;结合各元素的相对位置可知,B为P元素、A为Si元素,
A.B为P元素,其M层含有5个电子,B 的M层电子数是K层的$\frac{5}{2}$=2.5倍,故A错误;
B.C的两种为硫离子,含有3个电子层,钠离子含有两个电子层,两种离子的电子层结构不同,故B错误;
C.A 与D 形成的化合物为二氧化硅,二氧化硅为共价化合物,不是离子化合物,故C错误;
D.C 的简单阴离子为硫离子,D的简单阴离子阳离子,非金属性越强,对应离子的还原性越弱,则硫离子的还原性比氧离子的还原性强,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的逻辑推理能力.

练习册系列答案
相关题目
8.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
9.设NA为阿伏伽德罗常数的数值.下列有关叙述正确的是( )
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
16.高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g)?Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{C(C{O}_{2})}{C(CO)}$,△H<(填“>”“<”或“=”)0.
(2)在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1、CO的平衡转化率=60%.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol•L-1和0.1mol•L-1,则此时反应是否达到平衡否(填“是”或“否”),V(正)>V(逆)(填“>”“<”或“=”)
已知该反应在不同温度下的平衡常数如右表所示:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{C(C{O}_{2})}{C(CO)}$,△H<(填“>”“<”或“=”)0.
(2)在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1、CO的平衡转化率=60%.
(3)欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2mol•L-1和0.1mol•L-1,则此时反应是否达到平衡否(填“是”或“否”),V(正)>V(逆)(填“>”“<”或“=”)
3.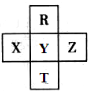 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )| A. | 原子半径 Z>Y>R | B. | R与Y的电子数相差8 | ||
| C. | 非金属性:Z>Y>X | D. | HZO4是目前无机酸中最强的含氧酸 |
13.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. |  干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. |  制备干燥的氨气 | D. |  吸收NH3 |
20.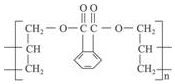 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
①烯CH2=CH2
②丙烯CH3CH=CH2
③丙烯醇(CH2=CH-CH2OH)
④邻苯二甲酸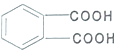
⑤邻苯二甲酸酯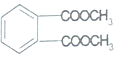
 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )①烯CH2=CH2
②丙烯CH3CH=CH2
③丙烯醇(CH2=CH-CH2OH)
④邻苯二甲酸

⑤邻苯二甲酸酯

| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
17.化学与社会、生活密切相关.下列做法中错误的是( )
| A. | 用食醋浸泡可除去水垢 | |
| B. | 用浓烧碱溶液作蚊虫叮咬处的淸洗剂 | |
| C. | 用明矾溶液的酸性淸除铜镜表面的铜锈 | |
| D. | 用浸泡过高锰酸钾溶液的硅土保存水果 |
18.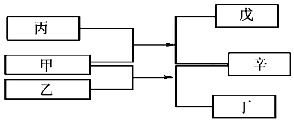 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |