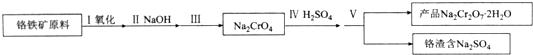
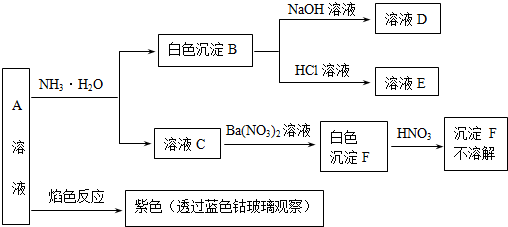
题目内容
13.下列说法正确的是( )| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
分析 A.O2的摩尔质量为32g/mol;
B.摩尔是物质的量的单位;
C.H2SO4的摩尔质量是98g/mol;
D.使用物质的量应指明具体的物质或微粒.
解答 解:A.O2的摩尔质量为32g/mol,1molO2在任何情况下都是32g,故A正确;
B.物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位,故C错误;
C.1mol H2SO4的质量是98g,H2SO4的摩尔质量是98g/mol,故C错误
D.1摩尔氢指代明确,不能确定是氢气还是氢原子,使用物质的量应指明具体的物质或微粒,故D错误,
故选:A.
点评 本题考查物质的量、摩尔质量,比较基础,注意使用物质的量应指明具体的物质或微粒.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
4.要除去石英沙中的少量杂质碳酸钙,可采用的方法是( )
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
1.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是 .
.
(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
18.将21.75g MnO2粉末与80mL 10mol•L-1的浓盐酸混合,在密闭容器中加热使其充分反应后,可得到标况下的Cl2的体积(V)是( )
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
2.小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
3.比较是化学学习中的一种重要方法.下列各组比较中错误的是( )
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |