题目内容
12.根据以下反应事实:(1)甲苯可使酸性KMnO4 溶液褪色,其反应是C6H5CH3 被氧化为C6H5COOH;
(2)CH3COONa+NaOH $\stackrel{△}{→}$ Na2CO3+CH4↑
请写出甲苯制成苯的各步反应式.
分析 根据甲苯好高锰酸钾之间的反应,可以得到苯甲酸,苯甲酸具有酸性,可以和氢氧化钠之间反应得到苯甲酸钠,根据信息(2),苯基酸钠在强碱氢氧化钠的作用下,可以发生减短碳链的反应得到苯,据此回答.
解答 解:根据甲苯好高锰酸钾之间的反应,可以得到苯甲酸,即5C6H5CH3+6KMnO4+9H2SO4→5C6H5-COOH+3K2SO4+6MnSO4+14H2O,苯甲酸具有酸性,可以和氢氧化钠之间反应得到苯甲酸钠,即C6H5-COOH+NaOH=C6H5COONa+H2O,根据信息(2),苯基酸钠在强碱氢氧化钠的作用下,可以发生减短碳链的反应得到苯,即C6H5COONa+NaOH→C6H6+Na2CO3.
故答案为:5C6H5CH3+6KMnO4+9H2SO4=5C6H5-COOH+3K2SO4+6MnSO4+14H2O、C6H5-COOH+NaOH=C6H5COONa+H2O、C6H5COONa+NaOH=C6H6+Na2CO3.
点评 本题涉及物质的性质以及信息的应用和物质的合成知识,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列各图所示的实验原理、方法、装置和操作正确的是( )
| A. |  除去Cl2中HCl | B. |  稀释浓H2SO4 | C. |  制取氧气 | D. |  称取NaOH |
7.Ge 和Sn 的熔点( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
1.按核外电子排布,可把周期表里的元素划分成5个区,以下元素属于s区的是( )
| A. | Fe | B. | P | C. | Mg | D. | Cu |
2. 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是熔融的铁被空气中氧气氧化.
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1 KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
①为确保A组实验在39℃下进行,应采用的控温操作方法是量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
②A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变.
③B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是熔融的铁被空气中氧气氧化.
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1 KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
②A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变.
③B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.
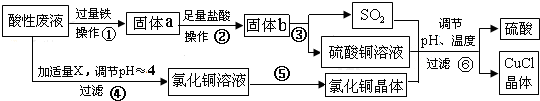
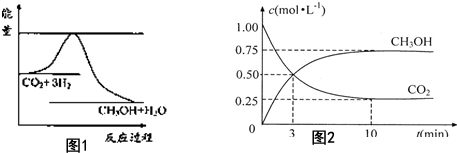 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)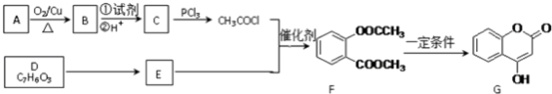
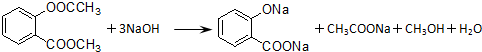 .
.
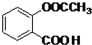 .
. .
.

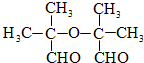
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
. .
.