题目内容
8.下列叙述正确的是( )| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 | |
| C. | 若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| D. | 1.0×10-3mol•L-1盐酸的pH=3.0;1.0×10-8mol•L-1盐酸的pH=8.0 |
分析 A.醋酸稀释后氢离子浓度减小,溶液的pH增大;
B.酚酞的变色范围为8-10,当溶液的pH小于8时酚酞溶液变为无色;
C.反应后溶液的pH=7,说明HCl与氢氧化钠的物质的量相等;
D.1.0×10-8mol•L-1盐酸的pH只能无限接近7,不可能大于7.
解答 解:A.某醋酸溶液的pH=a,将此溶液稀释1倍后溶液中氢离子浓度减小,溶液的pH增大,则a<b,故A错误;
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色时溶液的pH<8,但不一定<7,故B错误;
C.若1mL pH=1的盐酸的浓度为0.1mol/L,该盐酸与100mLNaOH溶液混合后溶液的pH=7,说明两溶液恰好反应,则n(NaOH)=n(HCl)=0.1mol/L×0.001L=1×10-4mol/L,则NaOH溶液的浓度为:$\frac{1×1{0}^{-4}mol}{0.1L}$=1×10-3mol/L,该NaOH溶液的pH=11,故C正确;
D.1.0×10-8mol•L-1盐酸呈酸性,溶液的pH小于7,不可能大于8.0,故D错误;
故选C.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
18.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. |  实验室制取Cl2 | D. |  中和热的测定 |
3.根据等电子原理判断,下列说法中正确的是( )
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
13.化学无处不在,下列用品的有效成分及用途对应错误的是( )
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
20.下列有关物质结构的表述正确的是( )
(1)次氯酸的电子式: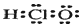
(2)Cl-的结构示意图: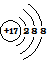
(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
(1)次氯酸的电子式:
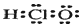
(2)Cl-的结构示意图:

(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
17.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
18.乙基环己烷( )的一溴代物共有几种(不考虑立体异构)( )
)的一溴代物共有几种(不考虑立体异构)( )
 )的一溴代物共有几种(不考虑立体异构)( )
)的一溴代物共有几种(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 .
.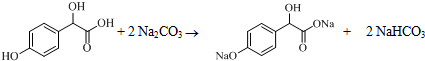 .
. .
.