题目内容
16.已知2L 0.5mol/L H2SO4溶液与足量稀NaOH溶液反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| C. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=+57.3 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
分析 n(H2SO4)=0.5mol/L×2=1mol,则1molH2SO4溶液与足量稀NaOH溶液反应生成2molH2O,放出114.6kJ的热量,中和热对应生成1molH2O时放热为57.3 kJ,以此来解答.
解答 解:n(H2SO4)=0.5mol/L×2=1mol,则1molH2SO4溶液与足量稀NaOH溶液反应生成2molH2O,放出114.6kJ的热量,中和热对应生成1molH2O时放热为57.3 kJ,中和热的焓变为负,则表示该反应中和热的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1,
故选D.
点评 本题考查热化学方程式书写,为高频考点,把握反应中能量变化、中和热判断为解答的关键,侧重分析与应用能力的考查,注意水的化学计量数,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.短周期主族元素X、Y、Z、U、W原子序数依次增大,X位于 IA族,Y原子最外层电子数是其内层电子数的2倍,Z的简单气态氢化物的稳定性最强,U是地壳中含量最多的金属元素,W与Z属于同一主族,下列叙述正确的是( )
| A. | 由X与W形成的化合物是离子化合物 | |
| B. | Z元素的最低化合价为-1,最高化合价为+7 | |
| C. | Y的最高价氧化物对应水化物的酸性比U的强 | |
| D. | Z的简单离子半径小于U的简单阳离子半径 |
7.科技工作者制造出厚度只有l微米的超薄太阳能电池.硅太阳能电池工作原理如图所示:

下列有关判断错误的是( )

下列有关判断错误的是( )
| A. | 硅原子最外层有4个电子 | |
| B. | 太阳能电池是一种化学电源 | |
| C. | 太阳能电池实现了光能向电能的转化 | |
| D. | B电极为电源正极 |
4.下列表示正确的是( )
| A. | -CH3(甲基)的电子式为 | B. | 乙烯分子的结构简式:CH2CH2 | ||
| C. | H2O分子的球棍模型: | D. | 氟的原子结构示意图: |
1.下列有关金属的工业制法中,错误的是( )
| A. | 制铝:电解熔融态氯化铝 | B. | 制铁:以铁矿石为原料,CO还原得铁 | ||
| C. | 制镁:电解熔融态氯化镁 | D. | 制钠:电解熔融态氯化钠 |
8.下列物质按照单质、氧化物、混合物的顺序排列的是( )
| A. | 铁、氧化铁、氯化铁 | B. | 冰、干冰、可燃冰 | ||
| C. | 氧气、二氧化碳、空气 | D. | 金刚石、铁矿石、石灰石 |
5.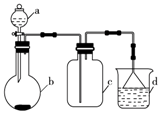 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A. | NH4+为正四面体形 | B. | CS2为直线形 | ||
| C. | ClO3-的空间构型为平面三角形 | D. | PCl3为三角锥形 |
 某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催
某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催